近日,美國生物科技公司Tempest Therapeutics發布治療肝癌的最新研究進展,隨後股價瘋狂“暴走”引發全球市場熱議。截止當日收盤,Tempest漲幅超過3972%報9.77美元,股價一日暴漲近40倍,成交額達5.18億美元。
由於肝癌具有高復發、高轉移、高致死率的特點,是全球範圍內常見的消化系統惡性腫瘤。根據國家癌症中心統計的數據,肝癌是我國死亡人數第二高的惡性腫瘤,僅次於肺癌。另外,肝癌發病隱匿,多數肝癌患者確診時已經是中晚期,治療的路徑選擇十分關鍵。
值得一提的是,在10月11日股價上漲近40倍後,Tempest股價出現連續2個交易日的下跌,但在10月16日,公司收漲85.16%,報6.74美元出現“高位企穩”跡象,從側面反映出盡管股價已經大幅上漲,但市場似乎對Tempest的股價反應穩定,說明市場已認可其在一线治療HCC方面的階段性成果。
以上市場表現足以說明在肝癌治療領域,階段性進步都可能引發市場對未來肝癌治愈前景的憧憬。
不過,在聚光燈外的港股市場,一家公司甚至做到晚期肝細胞癌治療中實現兩例逾7年無病生存的成就,但從股價表現來看,市場卻未能及時反饋。這家公司便是科濟藥業-B(02171)。
不同市場賽道,不同股價反應
作爲國內最早專注於CAR-T療法研發的藥企之一,科濟藥業在CAR-T治療實體瘤領域的研發一直處在國內前列。
早在2021年,科濟藥業便在ASCO年會公布了一項GPC3 CAR-T治療肝細胞癌的1期研究。6例患者接受治療,未發生劑量限制性毒性,未發生3級以上CRS或神經毒性。ORR 16.7%,DCR 50%,中位無進展生存期(PFS)4.2個月,顯示出一定的潛力。
而此次在HCC治療領域出現的兩例長期無病生存案例讓市場更進一步了解到科濟藥業在CAR-T治療肝癌領域的潛力。
據了解,早在2015年5月,上海仁濟醫院腫瘤介入科便聯合科濟藥業开展了全球首個靶向GPC3(Glypican-3)蛋白的CAR-T細胞治療晚期肝細胞癌(HCC)的臨牀試驗。當時2例晚期HCC患者在入組時已合並下腔靜脈癌栓,其中1例同時合並腹膜後淋巴結轉移,預期治療結局很不樂觀。
然而,此2例患者在經局部治療聯合CAR-T細胞輸注後效果顯著,在長期隨訪期間均呈無瘤狀態。日前,這兩位患者回到仁濟醫院再次完成復查,結果顯示仍然無腫瘤復發。其中一位患者已無瘤生存已超過8年(2015.07-2023.08),而另一位患者無瘤生存則超過了7年(2016.07-2023.08)。隨訪期間,兩例患者除口服抗乙肝病毒藥物,未行其他任何抗腫瘤治療。
目前這兩例長期無病生存案例已在《Cancer Communications》雜志發表並被錄用爲當期封面論文。

實際上,HCC是最常見的惡性腫瘤之一,全球每年約有78萬例新發病例。目前迫切需要新的治療技術和策略來改善這些患者的預後。
而對於HCC患者而已,復發和轉移是影響生存的主要因素,且對於並發下腔靜脈瘤栓的HCC患者,目前治療方案有限,總體預後較差,即使進行了手術切除,術後中位總生存期也只有17.8個月。對於接受其他局部或全身治療的患者,中位總生存期則在5.9個月到15.4個月不等。所以這兩例長期無病生存案例在一定程度上印證了科濟藥業在HCC實體瘤治療領域的實力。
不過相較於Tempest在一线治療HCC上取得進展美股市場的反應,港股市場對科濟藥業的這一階段性成果反應顯然“冷淡得多”。
觀察到,今年10月6日盤中,科濟藥業股價觸及上市以來新低7.68港元而後逐步回彈,10月12日公司宣布兩例長期無病生存案例後,公司當日收漲6.82%,次日收漲1.38%,雖然截至10月16日,公司區間最高股價回升至9.92港元,10日內區間最高漲幅也達到29.17%,但與Tempest一比顯然相形見絀。
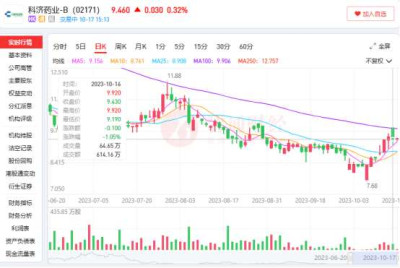
首款產品何時獲批更爲關鍵
從科濟藥業披露的中報來看,相比於尚處在I期研發的GPC3 CAR-T產品,科濟藥業當前的重心顯然是盡快推動核心產品CT053的上市和鋪开商業化。
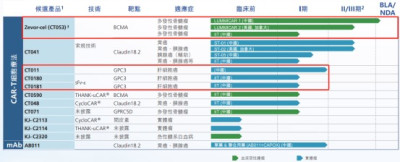
科濟藥業核心產品CT053曾被認市場爲是有望成爲國內首款獲批靶向BCMA的CAR-T療法。不過如今這個“美夢”已被另外一款同類產品所打破。
今年6月30日,NMPA官網最新公示,馴鹿生物與信達生物聯合开發的BCMA靶向CAR-T產品伊基奧侖賽注射液已獲批上市,用於治療復發或難治性多發性骨髓瘤(MM)成人患者,既往經過至少3线治療後進展(至少使用過一種蛋白酶體抑制劑及免疫調節劑)。
作爲國內3款已提交上市申請的BCMA CAR-T之一,伊基奧侖賽此次的順利獲批顯然讓國內在該領域實現了零的突破。只是幾家歡喜幾家愁,對於科濟藥業來說,競品率先一步上市,對其後續產品的商業化也是一個不小的挑战。
首先在於市場關心的產品有效性和安全性上,科濟藥業的CT053新藥上市申請是在去年10月18日獲得藥監局受理。CT053的上市申請受理是基於一項在國內進行的名爲LUMMICAR STUDY 1的开放、單臂I/II期臨牀試驗。截至2022年8月16日,102例患者的中位隨訪時間爲9個月,客觀緩解率爲92.2%,完全緩解率爲45.1%;安全性方面,102例患者均報告了治療相關的不良事件(AEs),AEs主要包括與清淋相關的血液學毒性,其中7例(6.9%)發生了3/4級細胞因子釋放綜合徵。
然而,當前國內共有3款BCMA靶向CAR-T產品遞交了上市申請,且從初步數據來看,3款產品ORR均能達到90%左右水平,整體展現出優於CD19靶點CAR-T治療的有效性和安全性。但這也意味着在最關鍵的產品療效上,科濟藥業的CT053並不能展現出明顯優勢,並且針對的復發/難治性多發性骨髓瘤(RRMM)市場已然出現衆多來自雙抗賽道的競爭對手。
在核心產品未來商業化局勢尚不明朗的同時,根據近期科濟藥業披露的2023年中報,公司爲了進一步推進管线內研發進程,公司當期淨虧損較上年同期擴大7.5%至4.04億元。不過公司目前現金及現金等價物和銀行存款仍有21.75億元,足夠公司未來數年的運營與研發。
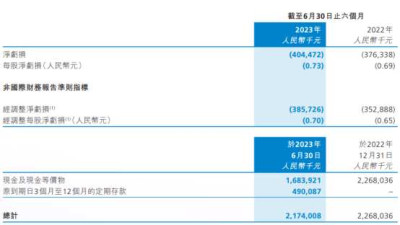
據了解,全球CAR-T產品在2022年大部分實現增長。FDA目前已批准6款CAR-T療法,合計銷售額達到27億美元,較2021年的17億美元增長明顯。其中吉利德Yescarta在2022年的銷售額達到11.6億美元,同比增長達到67%。而國內已公布的藥明巨諾CAR-T產品也實現了1.46億人民幣收入,呈快速增長趨勢。
而在今年上半年,百時美施貴寶的2款CAR-T療法Abecma、Breyanzi上半年銷售總額約爲4.5億美元,相較於去年同期的2.39億美金增長了88%;傳奇生物的Carvykti在而今年上半年合計銷售額1.89億美元,已經超過去年全年。
對於科濟藥業來說,全球BCMA CAR-T產品放量明顯顯然是一個利好,預示着全球CAR-T的蛋糕正在越變越大。不過在這一趨勢下,已上市的產品相對在研產品的先發優勢也或將越拉越大,從而影響公司的估值走向。因而決定科濟藥業當前估值走向的一大關鍵或許在於其首款產品何時獲批上市。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:股價再觸新低,兩例逾7年無病生存案例能幫科濟藥業-B(02171)反彈多久?
地址:https://www.breakthing.com/post/104006.html







