
深度解讀國外一线投行(Jefferies, Piper Sandler, SVB Leerink)關於康乃德生物醫藥最新臨牀結果的研報。
前言
2022年1月5日,作爲中國走向國際的新型biotech,康乃德生物醫藥公布了CBP-201項目臨牀II期試驗詳細數據(WW001)(NCT04444752),業界評價各異,國外投行給出了相對積極的解讀,但市場反應劇烈。藥渡參考國外主流投行的研報評論,更爲深入和客觀地對臨牀結果進行了評價。
當前中國biotech的研發創新已經進入了全新的階段,隨着藥物發現、臨牀前和臨牀研究等方面不斷完善,未來應對全球化競爭的能力會顯著提升。
特應性皮炎(AD)患者具有明顯的瘙癢、細菌感染等症狀,被認爲是非致命性疾病中疾病負擔第一的皮膚病。據估算當前全球AD患者已達3.8億(僅國內就有7千萬患者),預計全球AD市場規模已達到百億美元級別,至2025年可達193億美元(Frost & Sullivan預測)。如此龐大的市場空間急需且足夠容納多個創新藥物,而目前臨牀上常用的AD藥物多爲上市較早的局部治療用藥或口服激素/免疫抑制劑。療效有限且不良反應較多,用藥結構升級的需求迫切,特別是抗體類藥物亟待發展,國內創新藥企業有機會後來居上。
作爲全球首個獲批的治療中重度特應性皮炎的靶向生物制劑,靶向IL-4R的度普利尤單抗僅在2021年前三季度銷售額已達68億美元,未來數年可能跨入年銷售額百億美元行列。根據AD賽道中基於IL-4R靶點現有的各個在研產品在全球的臨牀試驗進度來看,國內領先企業康乃德的CBP-201一旦進入全球III期臨牀試驗,也就意味着它很有可能將以第二順位進入國際市場。
CBP-201最新的Phase IIb研究結果成功達到了預設終點,有效性和安全性得到了進一步證實。國際一线投行Jefferies, Piper Sandler和SVB Leerink(對生物醫藥行業的深入分析處於第一梯隊)[1-3],以及AD研究方面的權威專家Bruce Strober(耶魯大學醫學院皮膚病學臨牀教授)和Jonathan I. Silverberg(喬治華盛頓大學醫學與健康科學學院皮膚病學教授)等人均給出了積極的評價,對Phase III研究均持樂觀態度。與之對應,一些同行給出了不同的觀點。藥渡對其原因分析如下:
首先,在宏觀層面,AD的臨牀研究正處於發展和完善的過程之中。參考權威學者Jonathan I. Silverberg等人發表的綜述文章,相對於快速發展的創新療法,當前AD相關的臨牀研究在方案設計、執行和數據統計等方面還有許多繼續優化的空間[4]。對療效數據影響最大的五類臨牀研究關鍵變量分別是:comparators, rules for rescue treatment, washout periods for topical and systemic treatments, inclusion criteria (such as disease severity by Eczema Area and Severity Index and/or Investigator Global Assessment scores), and the duration of the screening period。 隨着越來越多創新AD藥物湧現,臨牀研究的關鍵變量也需要及時調整。
其次,從研發的視角來看,已上市的度普利尤單抗作爲IL-4R靶點的FIC產品,其臨牀試驗關鍵參數和終點指標是根據度普利尤單抗的特性進行優化的,未必適合其他同類產品。國內領先企業自主开發的抗體具有不同的特性,需要重新優化臨牀試驗關鍵參數,甚至是加入更多生物標志物的使用,對受試者進行更加精准的分層,才能夠最大程度地凸顯差異化的臨牀價值。
至於CBP-201項目Phase IIb研究的詳細數據,首先可以確定其成功達到了預設的主要和次要終點,其產生的過程有以下要素值得重點分析[5]:
a. 患者基线差異明顯,相比度普利尤單抗以往的Phase III臨牀試驗,總體上本次試驗入組的AD症狀相對較輕(n=226,EASI中位數爲21.2;IGA得分爲4的佔31%),AD持續時間較短(中位數爲13.0年),具有較低的BSA(中位數35.1%)和較高的BMI(中位數28.4 kg/m2)。而在中國人群亞組(n=32),AD更爲嚴重(中位EASI 26.9;38%IGA 4),BSA較高(中位42.5%),BMI較低(中位數25.6 kg/m2)。中國亞組人群基线更接近度普利尤單抗Phase III臨牀試驗披露的情況。
b. 區域分布不同,本次試驗涉及全球59個中心,包括USA (38), China (9), Australia (8), and New Zealand (4). 即使是同樣的入/排標准、終點指標,在不同國家地區的執行也可能有細微的偏差。
c. 治療中斷率偏高,特別是在試驗藥治療組(13%–19%),因此損失了一部分可能很有價值的療效數據。2b期研究中的絕大多數中止是由於患者撤回同意或患者失訪(不排除受疫情影響的因素)。
d. 研究的樣本量和統計效力通常是基於主要終點的統計學意義而設計的,特別是早期或者進行多個劑量探索的II期研究。在某些次要終點,部分試驗組療效數據與安慰劑相比P≥0.05是可以理解和正常的。
因此,事後分析來自EASI評分基线疾病嚴重程度較高的患者數據(n=69),相對於總體試驗人群,EASI評分較基线降低幅度更大,安慰劑反應更低。同樣,對具有較高基线胸腺和激活調節趨化因子(TARC或CCL17,與AD疾病活動相關的生物標志物)的患者(n=69)進行事後分析,與總體人群相比他們的 EASI 降低幅度更大且安慰劑反應更低,詳見下表:
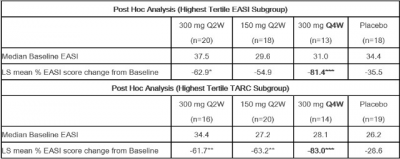
*PBaseline EASI tertiles: Low: ≤ 18.4, Mid: >18.4 and ≤26.4, High: >26.4Baseline TARC tertiles: Low: ≤ 116 pg/mL, Mid: >116 pg/mL and ≤291 pg/mL, High: >291 pg/mL
其中令人驚喜的是CBP-201在300 mg Q4W組的數據趨勢較好,相比Q2W給藥可能會帶來顯著的依從性提升。(度普利尤單抗在Phase II研究中嘗試過Q4W給藥,但後來並未延續,目前獲批的仍是Q2W給藥。而減少給藥頻率提升患者的依從性恰恰是該領域關鍵的未滿足需求之一[6])。
CBP-201的這一特點早在Phase Ia研究中就已經有所體現,Piper Sandler曾對此進行了解讀,指出單次皮下注射300 mg CBP-201可以維持血藥濃度>100ng/ml達到58天之久(度普利尤單抗爲42天)[7]。結合最新發布的Phase IIb研究數據,Piper Sandler對CBP-201 300 mg Q4W給藥的有效性/安全性持樂觀態度。
Piper Sandler的結論也在Jefferies的分析報告[1]中得到了印證,並指出了更多細節:
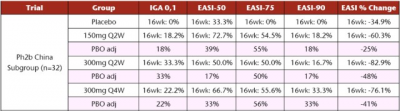
由上表可見,中國亞組人群中,300 mg Q4W組相較於300 mg Q2W組,IGA=0/1的受試者比例下降以及EASI變化百分比的下降在可以接受的範圍之內,而EASI-50/75/90應答率甚至更優,這也爲後續探索CBP-201每4周給藥一次的可行性提供了更多信心。此外,目前的數據表明CBP-201的安全性與安慰劑相當,例如注射部位反應極少出現(1.8%,n=170),上述機構普遍對後續擴大人群中的安全性數據持樂觀態度。
因此,後續聚焦於基线時疾病活動度較高的患者,CBP-201有望在未來的研究中展現出更加卓越的療效。國外專業機構Jefferies、Piper Sandler和SVB Leerink對CBP-201項目Phase IIb研究數據的評價基本一致,均認爲其成功實現了劑量探索和療效初步探索的預期目標,目前有限的數據不必過多的外推和比較,並對之後的Phase III研究持樂觀態度。更多細節已在2022年1月24日至28日舉行的第18屆Maui Derm年度會議上以摘要和海報的形式進行了介紹[8,9]。除AD之外,CBP-201還在推進哮喘和慢性鼻竇炎伴鼻息肉方面的Phase II國際多中心臨牀研究,國外專業機構對其全球化銷售前景持樂觀態度,預測年銷售峰值可達10億美金級別。

Bruce Strober(耶魯大學醫學院皮膚病學臨牀教授):
除了看起來至少與目前的抗IL-4R療法相當的療效數據外,CBP-201或許能夠每4周給藥一次,可以減輕患者的治療負擔並有助於改善依從性。我期待計劃中的III期試驗於2022年下半年开始。
結論
CBP-201的Phase IIb研究成功達到了預設的主要和次要終點,實現了劑量探索和療效初步探索的預期目標,也找到了進一步優化III期臨牀試驗設計和實施的线索,並且初步顯露出了差異化的臨牀價值。
現階段就比較CBP-201與度普利尤單抗孰優孰劣還爲時尚早,基於研究的整體結果和深入的分層及亞組分析結果,未來有pk的底氣,預期會取得較好的市場份額。
在全球化競爭背景下,未來會有更多國內領先企業向國際一线發起挑战。我們堅信,中國biotech一定會在國際舞台上大放異彩,前景可期。
針對中國biotech走向國際,藥渡將做系列報道,敬請期待。
*本文觀點僅供參考,不構成投資建議,作者對基於本文作出的任何行爲不承擔法律責任。
參考資料[1] Jefferies - WW001 Readout - 6th January 2022[2] Piper Sandler - CNTB - 5th January 2022[3] SVB Leerink - CNTB - 5th January 2022[4] Expert Perspectives on Key Parameters that Impact Interpretation of Randomized Clinical Trials in Moderate‑to‑Severe Atopic Dermatitis[5] Connect Biopharma官網公告[6] 中國特應性皮炎患者生存狀況調研報告[7] Piper Sandler - CNTB - 4th November 2021[8]https://www.connectbiopharm.com/wp-content/uploads/Maui-derm-2022_CBP-201_Poster-1_FINAL_10th-January-2022.pdf[9]https://www.connectbiopharm.com/wp-content/uploads/Maui-Derm-2022_CBP-201_Poster-2_FINAL_10th-January-2022.pdf
- 康乃德生物(CNTB)
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:Challenge the best——中國Biotech走向國際,系列報道(一)
地址:https://www.breakthing.com/post/2796.html







