
摘要:
信達生物PD-1首闖FDA受挫,被要求補充臨牀試驗;
GSK治療狼瘡腎炎藥物在華獲批;
阿斯利康騙保事件中涉案人員17名被抓;
國家醫保局稱今年要進一步擴大中成藥集採範圍;
輝瑞抗新冠口服藥物在日本獲得特別批准。
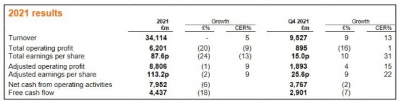
葛蘭素史克2021財年營業額同比增5%,調整後營業利潤同比增9%
葛蘭素史克(GSK.US)公布了2021財年第四季度及全年財務業績。財報顯示,該公司2021財年全年營業額爲341.14億英鎊,以固定匯率(CER)計(下同),同比增長5%;經調整的每股收益爲113.2便士,同比增長9%。
經調整的營業利潤爲88.06億英鎊,同比增長9%。該公司表示,這一增長主要反映了新冠肺炎解決方案與制藥部門的銷售增長、對持續性成本的嚴格控制、有利的法律協議以及整個業務持續重組帶來的好處。
信達生物PD-1首闖FDA受挫,被要求補充臨牀試驗
2月11日凌晨,美國食品藥品管理局(FDA)召开ODAC會議審評信達生物與禮來制藥的PD-1抗體信迪利單抗的結果出爐,專家委員會的最終投票結果爲14:1,即認爲信迪利單抗需補充臨牀試驗才能獲得上市批准。
同日,信達生物發布公告對此進行回應。根據公告,此次新藥上市申請申報適應症爲信迪利單抗注射液聯合培美曲塞和鉑類用於非鱗狀非小細胞肺癌一线治療,主要基於在中國开展的ORIENT-11臨牀三期試驗資料。委員會投票建議需要在獲批前補充額外臨牀試驗,證明信迪利單抗在美國人群和美國醫療實踐中的適用性。
深圳醫保局通報阿斯利康騙保事件:抓獲涉案人員17名,全部採取刑事強制措施
深圳醫保公衆號發布阿斯利康涉嫌騙取醫保案件簡要案情通報:2021年7月,深圳市醫保局根據舉報,核查發現阿斯利康工作人員涉嫌欺詐騙保,後在國家醫保局指導下,聯合深圳市公安局等相關單位進行專案查辦;經縝密工作,成功破獲該案件,打掉一個涉嫌篡改腫瘤患者基因檢測結果騙取醫保基金的詐騙團夥,抓獲涉案人員17名,全部依法採取刑事強制措施;目前,該案正在進一步偵查辦理當中。
泛生子與和黃醫藥達成沃瑞沙用於非小細胞肺癌的伴隨診斷合作協議
泛生子今日宣布與和黃醫藥(中國)有限公司達成合作協議,爲沃瑞沙(ORPATHYS,通用名:賽沃替尼/savolitinib)在中國市場共同开發伴隨診斷試劑盒。
根據協議,雙方計劃基於泛生子已經獲批的肺癌8基因試劑盒進行沃瑞沙的伴隨診斷驗證及注冊。肺癌8基因試劑盒基於泛生子“一步法”專利技術开發,於2020年獲中國國家藥品監督管理局(以下簡稱“國家藥監局”)批准上市。該試劑盒是國內首款獲批基於RNA水平檢測MET外顯子14跳躍變異的NGS產品,適應症爲非小細胞肺癌(NSCLC)。肺癌8基因試劑盒目前已在國內醫院展开應用,並於2021年獲得歐盟CE資質。
輝瑞抗新冠口服藥物在日本獲得特別批准
日本厚生省批准了輝瑞的新冠治療藥物Paxlovid,使其成爲繼美國默沙東公司开發的“莫那比拉韋”(Molnupiravir)後,第二種獲得特批的此類口服藥物,用於輕度至中度症狀的患者使用。
藥明巨諾-B獲平安證券首予其“推薦”評級並看高目標價至20.98港元
平安證券發布研究報告稱,首予藥明巨諾-B(02126)“推薦”評級,予整體估值85.60億港元,根據當前股本4.08億股,對應目標價20.98港元,考慮到其未來還有多款產品將持續推進臨牀,管线估值有望進一步提升。
報告中稱,公司最早由Juno和藥明康德合資成立,在Juno被BMS收購後,其合作關系被轉移到BMS,因此公司背靠全球龍頭藥企和國內龍頭CXO公司,是從巨人的肩膀上起步,逐漸獨立成熟的生物科技企業,產業資源豐富。公司首款CAR-T產品倍諾達已於9月獲批,成爲國內細胞治療商業化領軍者,目前已完成全流程管理體系搭建、創新支付體系探索和品牌效應打造,具備先發優勢。
國家醫保局:今年要進一步擴大中成藥集採範圍
國新辦今日召开政策例行吹風會,國家醫療保障局副局長陳金甫在會上介紹,提速擴面是常態化、制度化的應有之義。今年,國家醫保局將指導地方根據臨牀需要,圍繞大品種和常見病,查漏補缺進行推進,力爭每個省份开展的省級集採品種能夠達到100個以上,高值醫用耗材能覆蓋到5個品種。今年按照“一品一策”的原則對群衆反映多、價格調整空間大的耗材品種开展高值醫用耗材集中帶量採購,今年准備在骨科脊柱類耗材進行集中帶量採購。在地方這塊,進一步在其他領域進行探索。包括中成藥,在去年部分省份已經組織聯盟採購的基礎上,今年要有序進一步擴大範圍。
- 阿斯利康(US ADR)(AZN)
- 輝瑞(PFE)
- 信達生物(01801)
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:醫藥日報|信達PD-1首闖FDA受挫 被要求補充臨牀試驗;GSK狼瘡腎炎藥物在華獲批
地址:https://www.breakthing.com/post/3948.html







