6月5日,阿斯利康公布了Enhertu治療實體瘤的兩項的II期最新臨牀數據,包括實體瘤的DESTINY-PanTumor02和結直腸癌的DESTINY-CRC02。

DESTINY-PanTumor02
DESTINY-PanTumor02 II期試驗旨在評估Enhertu對局部晚期、不可切除或轉移性的先前治療過的、不符合治愈性治療的HER2表達的實體瘤患者的療效和安全性,包括膽道癌、膀胱癌、癌、內膜癌、巢癌、胰腺癌和罕見癌症。
結果顯示,經調查員中期分析評估,證實總體ORR爲37.1%,其中CR爲15名(5.6%),PR爲84名(31.5%),123名(46.1%)患者達到疾病穩定,疾病控制率(DCR)爲68.2%。
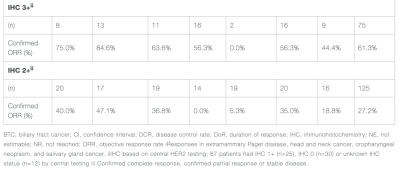
其中在HER2表達水平最高(IHC 3+)的患者中觀察到更大的反應,ORR爲61.3%。
在DESTINY-PanTumor02所有獲得反應的患者中,近一半(49.6%)在一年後仍保持反應。在整個試驗人群中,中位反應時間(DoR)爲11.8個月(95%[CI] 9.8-NE),在IHC 3+表達的患者中,中位反應時間爲22.1個月(CI 9.3-NE)。

安全性方面,與之前一致,有20名患者(7.5%)出現了與Enhertu治療有關的間質性肺病(ILD)或肺炎,其中1例死於ILD。

阿斯利康首席醫療官兼腫瘤學首席开發官Cristian Massacesi說: "雖然HER2是乳腺癌、胃癌、肺癌和結直腸癌的既定生物標志物,但DESTINY-PanTumor02試驗的數據驗證了HER2是一種跨越廣泛腫瘤類型的可操作生物標志物。Enhertu是第一個在HER2表達的實體瘤中表現出廣泛活性的治療方法。
DESTINY-CRC02
DESTINY-CRC02是一項在經標准化療治療後進展的BRAF野生型、RAS野生型或突變型的局部晚期、不可切除或轉移性HER2陽性(IHC 3+或IHC 2+/原位雜交[ISH]+)結直腸癌患者中,評估Enhertu兩種劑量(5.4 mg/kg或6.4 mg/kg)療效和安全性的全球II期臨牀試驗。
在主要終點分析中,經BICR評估,5.4mg/kg和6.4mg/kg組的患者確認的ORR分別爲37.8%(95%CI 27.3-49.2)和27.5%(95%CI 14.6-43.9)。所有的反應(n=42)都是PR,其中5.4mg/kg組的40名(48.8%)患者和6.4mg/kg組的23名(57.5%)患者實現了疾病穩定。
與5.4mg/kg治療組中IHC 2+/ISH+ HER2狀態的患者相比,HER2表達水平最高(IHC 3+)的患者療效更高(46.9% ORR(95% CI 34.3-59.8))。無論RAS突變狀態如何(39.7%有RAS突變;28.6%無RAS突變),在5.4mg/kg治療組中,先前接受過HER2導向治療的患者(41.2%)都有抗腫瘤療效。
5.4mg/kg(95%CI 4.2-8.1)和6.4mg/kg(95%CI 3.7-NE)組的中位DoR爲5.5個月,兩個組的中位隨訪時間分別爲8.9個月和10.3個月。5.4mg/kg組的中位無進展生存期(PFS)爲5.8個月(95%CI 4.6-7.0),6.4mg/kg組爲5.5個月(95%CI 4.2-7.0)。5.4mg/kg組的中位總生存期(OS)爲13.4個月(95%CI爲12.5-16.8),6.4mg/kg組則未達到(95%CI爲9.9-NE)。
安全性方面,有12例(5.4mg/kg組爲8.4%,6.4mg/kg組爲12.8%)治療相關的ILD或肺炎的報告,大多數(5.4mg/kg:8.4%,6.4mg/kg:10.2%)爲1或2級。

初步結果支持 5.4mg/kg 作爲HER2 陽性轉移性結直腸癌患者的最佳Enhertu劑量。
關注wechat藥研網
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:2023 ASCO丨Enhertu泛癌種最新數據公布
地址:https://www.breakthing.com/post/65203.html