反內卷
作者:鄭敏芳
編輯:松壑
作爲抗癌藥的明星靶點,PD-1正在迎來新挑战。
6月12日,嘉和生物(6998.HK)宣布PD-1藥物“傑諾單抗”的上市遭藥監局否決。
“本公司已獲中國國家藥品監督管理局告知,傑諾單抗(GB226)用於治療復發/難治性外周T細胞淋巴瘤(PTCL)的新藥上市申請未獲批准。”嘉和生物表示。
據嘉和生物解釋,主要原因在於該藥物的適應症“PTCL”亞型較爲復雜,監管部門對此持謹慎態度。
這是藥監局首次對PD-1藥物上市投下否決票。
在不少市場人士看來,這對於目前已擁有PD-1上市藥品或正處於臨牀階段的藥企都將構成重重挑战。
一方面,對於已擁有PD-1上市藥品的企業來說,若想拓展更多適應症則必須能夠證明其較同類藥品具備優異的臨牀效果,否則獲批難度激增。
另一方面,針對處於臨牀階段的PD-1藥品,藥企也需要向監管部門提交更能證明臨牀療效的數據,這或許也將提升藥企研發的成本。
多重壓力之下,PD-1藥物上市或正在面臨更多不確定性。
據信風(ID:TradeWind01)不完全統計,截至6月13日,有不少17家“A股+港股”公司正在持續推進PD-1藥物的研發。
這些公司後續的藥品上市是否會面臨更多風險,正受到多方關注。
01
PTCL遇阻
生存率低、復發率高、缺乏有效治療方案,一直是身患復發/難治性外周T細胞淋巴瘤(r/r PTCL)患者的痛。
據弗若斯特沙利文的統計,2019年中國約有2.26萬例新增PTCL患者,預計2024 年、2030年新發病例數將分別達到2.54萬例和2.90萬例。
“我們認爲全球 PTCL 患者規模呈現長期穩定擴容趨勢,而同時臨牀缺乏有效治療手段,該領域存在較大未被滿足的市場需求。”天風證券醫藥首席分析師楊松表示。
將目光聚焦於r/r PTCL的嘉和生物卻面臨慘敗。
6月12日,嘉和生物宣布“傑諾單抗”的上市遭藥監局否決。
“本公司已獲中國國家藥品監督管理局告知,傑諾單抗(GB226)用於治療復發/難治性外周T細胞淋巴瘤(r/r PTCL)的新藥上市申請未獲批准。”嘉和生物表示。
據嘉和生物解釋,主要原因在於PTCL亞型過多,監管部門對此持謹慎態度。
“這款藥物的適應症外周T細胞淋巴瘤包括有超過20種亞型,各亞型發病機制非常復雜,部分亞型發病機制尚不明確。目前全球沒有PD-1產品被批准用於PTCL的治療,所以國家藥監局藥審中心(CDE)對於相關適應證產品的審評就更爲謹慎。”嘉和生物如此回應被拒原因。
信風(ID:TradeWind01)據此向嘉和生物求證是否仍繼續开發PTCL適應症的相關藥物,其表示藥物研發重點已轉爲其他類型的藥物。
“從2022年开始,嘉和的核心產品就轉變爲鹽酸來羅西利片(GB491,Lerociclib,CDK4/6)和GB261(CD3/CD20)雙抗、GB263T(EGFR/cMET/cMET)三抗。目前這三款核心產品的進展都非常順利。”嘉和生物對信風(ID:TradeWind01)表示。
嘉和生物的“傑諾單抗”遭拒或許也給目前正在研發PTCL相關藥物的創新藥企帶來“陣陣寒意”。
據信風(ID:TradeWind01)不完全統計,截至6月13日,中國生物制藥(1177.HK)、迪哲醫藥(688192.SH)、復旦張江(688505.SH)等上市公司仍在持續研發PTCL的相關藥物,均處於臨牀階段。
作爲進展較快的藥企,迪哲醫藥旗下適用於r/r PTCL的藥物“戈利昔替尼”目前正處於2期臨牀試驗中。爲了推動該藥物的研發,迪哲醫藥正在籌劃26.08億元的定增,目前處於首輪問詢環節。
值得注意的是,“0收入”的迪哲醫藥仍未有產品實現商業化,2022年歸母淨虧損達到7.36億元。“戈利昔替尼”是在研管线中距離商業化目標較近的核心產品之一。
信風(ID:TradeWind01)也向迪哲醫藥求證該事件的潛在影響,其表示研發“正常推進中”。
“(傑諾單抗上市受阻)事情對我們沒有影響,我們都還在正常推進中,目前全球多中心臨牀試驗已經進入2期了。”迪哲醫藥向信風(ID:TradeWind01)表示。

02
雙面夾擊
PD-1已是明星靶點。
公开數據顯示,全球研究PD-1/PD-L1抑制劑的臨牀試驗已突破5600項,期間也有不少PD-1藥物獲得藥監局批准順利上市。
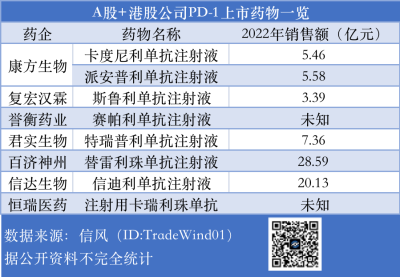
據信風(ID:TradeWind01)統計,從2018年至2022年國內共有百濟神州(688235.SH)等不少於7家上市公司的PD-1藥物斬獲上市注冊證,2022年銷售額合計已超過70億元。
其中百濟神州的“替雷利珠單抗注射液”和信達生物(1801.HK)的“信迪利單抗注射液”銷售額較爲可觀,2022年分別爲28.59億元和20.13億元。
但傑諾單抗的上市失敗給這一明星靶點“澆了一盆冷水”。
公开資料顯示,這是藥監局首次對PD-1藥物上市投下否決票。
在不少市場人士看來,這只是开始,未來或許會有更多藥企的PD-1藥物上市將會面臨阻礙。
一方面,對於目前已經上市的PD-1藥物來說,未來適應症的拓展難度激增。
“拓展已經上市的PD-1藥物的適應症可能會變難。這是第一個被否的PD-1,算是一個信號。以後me-too類的藥品如果不能展示出具有更好的臨牀價值,批准的可能性會變小。”北京一位創新藥分析師對信風(ID:TradeWind01)表示。
目前最具拓展適應症實力的是早有上市藥品的“PD-1四小龍”君實生物(688180.SH)、信達生物、恆瑞醫藥(600276.SH)和百濟神州。
據信風(ID:TradeWind01)不完全統計,君實生物、信達生物、恆瑞醫藥和百濟神州分別爲旗下PD-1已上市產品遞交了15、7、13和30項補充臨牀試驗。
“過去大家對這種明星靶點的期待除了說現有的適應症以外,還希望就是說潛在的適應症拓展,這樣的話相當於一款藥物可以獲得更多的增量空間。因爲找靶點太難了,所以如果說可以在已經得到印證的靶點上尋求更多空間,那可能就會容易一點,投資人也喜歡這種確定性。”北京一位從事醫藥行業並購的投行人士對信風(ID:TradeWind01)解釋稱,“但是現在監管層可能會希望藥企拿出更優異的臨牀數據,如果說做不到和同類藥品更突出的效果,估計以後獲批的難度會提升,這對於整個PD-1藥物研發的企業是很大的考驗。”
更爲艱難的或許是,目前仍在推進PD-1藥物臨牀試驗的企業。
“拓展適應症的路不好走,那現在藥品還在臨牀試驗的衝擊可能會更大。”北京一位創新藥分析師對信風(ID:TradeWind01)表示。
據信風(ID:TradeWind01)不完全統計,目前百奧泰(688177.SH)、百利天恆(688506.SH)、中國生物制藥等不少於13家上市公司的PD-1在研藥物已獲得臨牀批件。
部分公司向信風(ID:TradeWind01)確認臨牀試驗處於正常推進中。
例如中國生物制藥子公司正大天晴藥業集團南京順欣制藥有限公司自主研發的“TQB2868注射液”主要用於肝細胞癌等適應症,其向信風(ID:TradeWind01)確認“目前一切順利進行中”。
橫亙在布局PD-1靶點藥企面前的困境不僅於此,“出海”的難度也在悄然提升。
2022年2月、7月,信達生物和禮來制藥共同开發的PD-1抑制劑“信迪利單抗”、百濟神州的“替雷利珠單抗”就先後由於被FDA要求補充更多臨牀數據而“出海”失敗。
據市場人士總結,藥企或需要補充“頭對頭試驗+全球臨牀項目”的實驗數據,這無疑提升了藥企的研發成本。
“‘頭對頭試驗’需要證明你比同類藥品表現優秀或者不差,全球臨牀項目的話需要充分考慮到不同人種之間的差異性等,及時修正相關缺陷,但是這也對藥企的資金各方面都提出了更高的要求。”一位南方的創新藥研究人員表示。
如此一來,PD-1靶點的熱潮是否會退去,相關藥企又該何去何從,都成爲了擺在面前的難題。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:PD-1首度折戟:10余家上市公司“瑟瑟發抖”
地址:https://www.breakthing.com/post/67801.html







