
6月3日,諾和諾德司美格魯肽注射液在國內的上市申請正式獲藥監局受理。根據相關內容顯示,諾和諾德司美格魯肽注射液此次申報爲適應症擴容,當前該藥品在國內僅用於治療成人2型糖尿病及降低T2DM合並心血管疾病患者的心血管不良事件風險。
此次申報添加了減重適應症——作爲低卡路裏飲食和增加體力活動的輔助治療用於初始體重指數(BMI)≥30kg/m(肥胖),或≥27kg/m且<30kg/m(超重)並且伴有至少一種與超重相關合並症的成人患者。
司美格魯肽注射液是一種新型長效胰高糖素樣肽-1(GLP-1)類似物,與人GLP-1有94%的序列同源性,通過刺激胰島素分泌和降低胰高血糖素分泌的機制來降低血糖。
由諾和諾德公司2021年推行的相關產品Wegovy原先是一種治療糖尿病的藥物,後被列爲減肥產品。其還有個更早上市的“姊妹藥”,名叫Ozempic,二者的有效成分一致,都是司美格魯肽,只是劑量和包裝略有不同。
諾和諾德是總部位於丹麥首都哥本哈根的生物制藥公司,其糖尿病治療的胰島素產品處於世界領先地位。根據諾和諾德2022年財報顯示,其銷售收入的迅速增長主要得益於GLP-1受體激動劑血糖控制類產品銷售收入的迅速增長。諾和諾德GLP-1受體激動劑產品2017年銷售收入僅爲37億美元,佔諾和諾德全部銷售收入的21%。隨後逐年增長,2022年已經增至120億美元,佔諾和諾德全部銷售收入的47%,接近過半。
近日諾和諾德公布2023年一季度財報,由於司美格魯肽需求強勁,諾和諾德銷售額爲91億美元,同比增長25%,超出預期。
可見司美格魯肽不僅成爲了糖尿病市場領域的最大品類,同時在減肥減重方面深受追捧。
值得注意的是,雖然FDA(美國食品藥品監督管理局)已經批准司美格魯肽用於慢性體重管理。但國內尚未有此類產品獲批減重相關的適用症。
群雄逐鹿,國內藥企早已加入战局
根據太平洋證券整理的司美格魯肽原料藥登記備案情況,2023年1月,諾泰生物(688076.SH)與蘇州天馬醫藥集團旗下天吉生物制藥有限公司均登記了司美格魯肽原料藥並獲受理。2023年1月11日該消息發布,諾泰生物的股價直接拉升漲停。6月3日周六,司美格魯肽注射液適應症擴容申請正式獲藥監局受理後,6月5日周一,諾泰生物一度高开而後回落,但仍收獲5.95的漲幅,而6月6日公司股價繼續上漲11.49%。
據CDE官網數據,目前國內申報司美格魯肽原料藥登記申請還有湖北健翔生物制藥有限公司和浙江湃肽有限公司,證監會官網顯示,浙江湃肽有限公司目前爲IPO輔導驗收,輔導機構爲華泰聯合證券。
司美格魯肽原料藥的密集登記備案也印證了業內對海內外GLP-1類藥物發展前景的關注和追捧。除了原料藥外,中國藥企也在同步加速布局“減重”市場以及GLP-1類藥物的研發。
司美格魯肽中國專利將於2026年到期,此前,初代GLP-1藥物利拉魯肽在中國專利已於2017年到期,利拉魯肽、司美格魯肽等GLP-1受體激動劑均在減重方面具備一定效果和應用。介於利拉魯肽的專利過期,仿制藥和改良新藥的开發也在提速,華東醫藥(000963.SH)、通化東寶(600867.SH)、翰宇藥業(300199.SZ)以及正大天晴藥業集團股份有限公司已提交2型糖尿病適應症的上市申請。
通化東寶此前回復投資者問題時表示,公司在研產品包括利拉魯肽、索馬魯肽,一類創新藥GLP-1小分子(THDBH110/111)和GLP-1/GIP雙受體激動劑(注射用 THDBH121),其中利拉魯肽預計於今年年底獲批上市。
值得注意的是,華東醫藥還提交了相關藥品肥胖適應症的上市申請,其爲首個申報GLP-1類藥品減肥適應症的國內藥企。與此同時,華東醫藥還向諾和諾德的專利發起挑战,也讓國內司美格魯肽的明爭暗鬥更加白熱化。
2021年6月10日,華東醫藥子公司杭州中美華東制藥有限公司(以下簡稱“中美華東”)向國家知識產權局遞交司美格魯肽專利無效申請。而前文已提及,司美格魯肽的專利保護期原爲2006年到2026年。
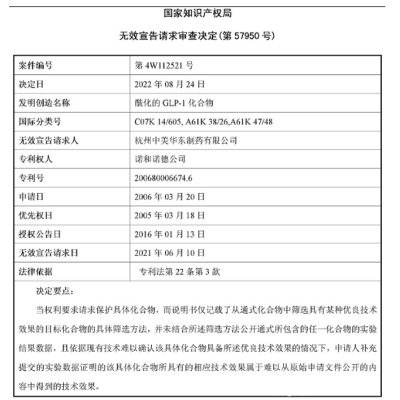
2022年9月5日,國家知識產權局判定司美格魯肽核心專利(CN200680006674.6)全部無效。根據國家知識產權局披露的文件,專利無效宣告的原因是諾和諾德最早提交司美格魯肽專利時,其說明書僅記載了從通式化合物中篩選具有某種優良技術效果的目標化合物的具體篩選方法,並未結合所述篩選方法公开通式所包含的任一化合物的實驗結果數據。而後其再次補充提交數據時,相關材料又無法證明原始申請文件中公开的技術效果。對此,諾和諾德表示,已上訴至北京知識產權法院,後續將進入知識產權訴訟階段。
6月8日,華東醫藥官方微信公號發布消息稱中美華東的創新口服小分子GLP-1受體激動劑HDM1002片Ⅰa期臨牀試驗在重慶醫科大學附屬璧山醫院Ⅰ期臨牀試驗中心完成首例受試者入組及給藥。據悉,HDM1002片是口服GLP-1受體激動劑。
同時,華東醫藥在此前的投資者問答中回復稱公司的司美格魯肽注射液產品計劃2023年下半年進入Ⅲ期臨牀試驗。圍繞GLP-1受體靶點,華東醫藥已布局了包括口服、注射劑等創新藥和生物類似藥。
而信達生物(01801.HK)旗下研發的GLP-1類藥物——瑪仕度肽(IBI362)同樣是有力競爭者。
2023年5月11日,信達生物公告宣布瑪仕度肽高劑量9 mg在我國肥胖受試者的II期臨牀研究中24周主要研究終點達成。據該項臨牀研究數據,瑪仕度肽在24周治療後觀察到了超過相較安慰劑15%的降幅和接近30斤的體重降低,體重百分比和絕對值降低在目前同類測試之中爲最佳。
同時,瑪仕度肽开發了6mg和9mg雙規格不同適應症,也是目前全球範圍內第一個基於肥胖程度开發個性化給藥方案的藥物。
據信達生物在報告中預估,瑪仕度肽6mg劑量組預計2023年底或2024年初讀出三期完整臨牀數據,並有望於2024年底或2025年初上市,或爲國內研發進展最快的該類型減肥新藥。
麗珠集團(000513.SZ)也在投資者問答表中表示,多年前就啓動了司美格魯肽的早期研發工作,去年下半年獲得臨牀批件,該項目已進入臨牀III期階段,計劃於今年完成入組並推進相關試驗,預計24年報產,爭取25年獲批,目前在做糖尿病適應症,下一步考慮減肥適應症。
衆藥企對着司美格魯肽虎視眈眈是因爲這背後的蛋糕可謂相當之大。
根據國金證券研報顯示,全球共有4.63億人患有糖尿病,平均每10個成人(20-79 歲)中有1個患有糖尿病,預計到2030年糖尿病病人達到5.8億人,到2045年糖尿病人數躍升至7億人。
我國糖尿病患者人數由9000萬增加至1.4億,增幅達56%,其中約7283萬名患者尚未被確診,比例高達51.7%。未來20余年,雖然我國糖尿病患病率增速會趨於平穩,但患者總數將可能增加到2030年的1.64億和2045年的1.75億。國金證券研究估計,GLP-1 藥物在糖尿病患者中應用市場空間將達到281.3億元。
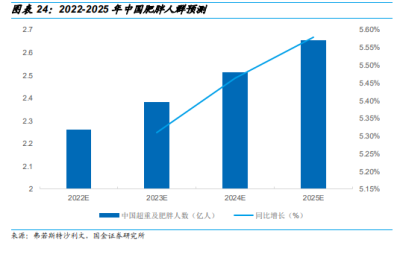
預計未來我國超重及肥胖人數將繼續呈增長趨勢,預計2025年中國超重及肥胖人數將突破 2.65 億人。
根據資料顯示,針對肥胖症司美格魯肽注射液的起始劑量爲0.25mg,每周一次;4周後,應增至0.5mg,每周一次治療至少4周後,劑量可增至1mg/每周一次。研究報告中以此推算則一年需要使用15支,人均年度治療費用2700元,在以上假設下,GLP-1 藥物在肥胖患者中應用市場空間將達到243.6億人民幣。
由此可見,國內糖尿病治療和減重市場想象力驚人。
“神”藥亦有三分“毒”
在我國,司美格魯肽的減重適應症目前仍處在申請受理階段,尚未獲批。同時司美格魯肽是一種處方藥,需要完全按照目前國家對處方藥的有關管理辦法措施進行管理。患者需要通過正規醫院渠道獲取該藥,並在醫生的指導下使用。
此次司美格魯肽申請減重適應症,用藥量與之前有所改變。根據資料顯示,用於治療2型糖尿病,患者每周注射1毫克,用於減重適應症,則需要每周注射2.4毫克。
而且司美格魯肽的使用都有很多注意事項和條件限制,並非人人適用。例如,有甲狀腺髓樣癌、急性胰腺炎患病史及多發性內分泌腺瘤家族史等的人群,是不能使用司美格魯肽的;血脂非常高以及嗜酒人群、1型糖尿病人群及孕婦同樣不建議使用。
使用司美格魯肽還有許多不良反應和禁忌,根據目前司美格魯肽使用後的反饋,較爲普遍的不良反應就是胃腸道反應,包括腹脹、惡心、嘔吐、腹瀉等。同時司美格魯肽還有很多罕見且嚴重的副作用,有研究表明司美格魯肽可能會加重糖尿病視網膜病變患者的症狀,嚴重的甚至可能會影響膽囊,導致使用者出現膽囊炎、膽汁淤積等情況。
而且普通的肥胖可能並不能稱之爲“病”,Wegovy在國外因減肥作用而火爆全網的同時,隨之而來的還有搶購帶來的副反應——糖尿病患者無藥可用。
根據社交媒體和相關報道,此前國外糖尿病患者們紛紛表示,他們需要花上幾個小時才能找到附近有這種處方藥的藥店;一些患者甚至不得不減少該類藥物的劑量,或者改用其他替代藥物。該領域醫生稱,藥物短缺使糖尿病患者更難保持低血糖水平,並增加了他們患上腎髒疾病和血管損傷等並發症的風險。
而司美格魯肽藥品的供不應求以及國內仍爲處方藥的前提,也讓假藥販子有了可乘之機。根據央視財經6月6日的報道稱,前不久浙江紹興諸暨警方就破獲了一起非法研發、生產、銷售含有“司美格魯肽”成分的假藥案件,涉案金額超過1億元人民幣。犯罪嫌疑人將產品描述爲打一針無需喫藥,無需節食,一個月能瘦二三十斤。他們將此類藥品神化,吸引消費者進行購买,用於減肥。而其生產成本和最終售價差額可高達50多倍。(《理財周刊-財事匯》 陳思瀛)
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:“減肥神藥”司美格魯肽國內上市申請獲受理 藥企布局哪家強
地址:https://www.breakthing.com/post/68374.html







