華爲是一家值得尊敬的國產企業,也是以實體企業起家轉型數字化的先驅。數字化驅動了華爲不竭的增長動力,盡管外部環境紛繁復雜,2022年其營收依然高達6423億人民幣。
那么,如果把華爲數字化轉型的思考、經驗、工具賦能到醫藥企業,會產生什么樣的效應?
今年3月,兩辦發布重磅文件《關於進一步完善醫療衛生服務體系的意見》,提出要發揮信息技術支撐作用,加快推進互聯網、區塊鏈、物聯網、人工智能、雲計算、大數據等在醫療衛生領域中的應用。
目之可見的是,以傳統模式經營的藥企生存空間正在遭到嚴重擠壓,想要贏在未來,數字化轉型已成必然趨勢。
當華爲雲碰撞醫藥企業,“上雲”、萬物互聯、數據大模型...會以怎樣的形式在醫藥行業應用落地?新技術又將如何激活下一輪產業勢能?
01
入局醫藥行業,華爲雲能做什么?
默沙東被稱爲是“最舍得花錢搞研發的藥企”,也以高效研發而著稱,根據2022年財報,其全年營收592.83億美元,兩筆費用支出的“落差”很有意思。
研發投入:135.48億美元,佔銷售額的22.9%,在行業之中名列前矛;
銷售和管理費用:100.42億美元,佔銷售額的16.9%,在純藥TOP 10中幾乎墊底。
粗略估算,2022年默沙東每賣出1塊錢的藥,營銷只需花費1毛7。已經是可以“碾壓”同行的存在。
究其原因,離不开默沙東對企業管理效率大刀闊斧的改革重塑。據默沙東高管公开表示,從2015年之後,默沙東就逐步將數字化營銷渠道向雲端搬遷,包括內部管理、藥物研究、臨牀研究、患者服務、市場營銷等方方面面,“數字化轉型是一個非常有效、持續去連接客戶的手段和方法。”
不止默沙東,過去十年間,輝瑞、羅氏、拜爾、飛利浦等頭部企業,紛紛使用雲計算、5G、互聯網、大數據等技術,來推動內部和外部的數字化轉型和創新,重塑競爭力。
視角切換至國內,後疫情時代,行業對於數字化的認知越加深刻,如何成功开展數字化轉型,成爲所有企業面臨的重要課題。
讓千行百業不再“望雲卻步”,降低AI應用門檻,這一站,華爲雲恰好走到了醫藥行業。
7月30-31日,華爲雲聯合上海市歐美同學會生物醫藥分會,舉辦第四期【走進華爲·數字化轉型總裁班】,聚焦於醫藥行業,邀請40+頭部藥企高管走進華爲,在東莞三丫坡分享了企業文化、數字化轉型經驗,與藥企夥伴共同探討了未來數字化的轉型創新方向。
華爲雲生物醫藥行業總經理樸雪花表示,醫藥行業正面臨新的發展拐點,在各個層面都產生了海量數據,而數字化、AI技術可以更深入地挖掘這些數據,這場IT賦能BT(生物科技)的浪潮,華爲已做好准備,成爲該產業鏈中最懂行業的雲計算供應商,與此同時,讓醫藥行業的客戶和夥伴們聚焦業務本身做創新,實現更好的企業發展。
02
當華爲雲盤古大模型應用於AI制藥
從互聯網醫院的崛起,到AI醫學影像的火熱,醫療行業的“AI屬性”似乎越來越濃。特別是近期被ChatGPT帶火的數據大模型,成爲當下熱議話題,行業內都在思考如何用其爲自我賦能。
月亮並非都是海外的圓。其實,早在GPT技術趨於成熟之前,華爲雲就涉足了生物醫藥垂直領域大模型的开發工作。
2021年4月,華爲雲發布盤古系列預訓練大模型,包括自然語言處理(NLP)大模型、計算機視覺(CV)大模型、多模態大模型和科學計算大模型。
同年9月,盤古藥物分子大模型發布,由華爲雲深度聯合中國科學院上海藥物研究所共同訓練完成,旨在幫助醫藥公司开啓AI輔助藥物研發的新模式。
2022年,作爲國內首個商用的AI輔助制藥SaaS平台,華爲雲AI輔助藥物設計平台獲得SAIL之星獎(Super AI Leader),這是人工智能領域的全球頂級獎項。
幫助藥企減少試錯成本、加速新藥研發進程...盤古藥物分子大模型正通過實例,一步步證明自己對於藥物研發的價值所在。
雙十定律被打破,AI 或成新藥研發“基礎設施”
盤古藥物分子大模型的發布恰逢其時。
衆所周知,創新藥研發是反摩爾定律的存在,低垂的果實被摘完,研發周期就會越來越長、難度也會越拉越大。
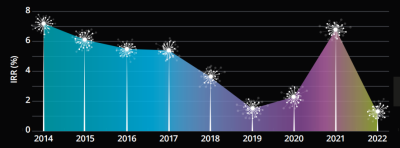
德勤報告顯示,2022年,全球新藥开發又難出新高度:平均成本達到爲22.84億美元;平均臨牀試驗周期(I期到-III期)約爲6.74年,其中腫瘤藥耗時最久,達到11.6年。
雙十定律被輕易打破,新藥研發平均回報率(IRR)下降至1.2%,創下近九年新低。

Cr:德勤《醫藥創新回報率評價》2022報告
在此背景下,新藥开發亟需新的賦能,而AI大模型的出現,有望成爲推動產業智能升級的關鍵技術之一,觸發新一輪新藥开發的“大爆炸時刻”。
相關報告顯示,AI平均可以縮短75%的藥物研發周期,大幅降低藥物設計成本,且將藥物研發成功率提升10倍以上。
全球TOP藥企正在引領這一輪技術升級趨勢,羅氏、輝瑞、諾華、默沙東、GSK、艾伯維、強生、賽諾菲、BMS...或是自建團隊、或是合作外包,紛紛進行了AI藥物研發的布局,相應也收獲了更加高效的回報。AI正在朝着未來新藥研發“基礎設施”的方向演進。

全球TOP藥企AI研發項目及論文發表。資料來源:《 Drug Discovery Today》
降本增效,助力Biotech在“寒冬”之中活下去
過去兩年,生物科技泡沫破裂,行業整體降溫重組,公司紛紛开源節流,裁員、砍管线、賣工廠的消息一波接着一波,沒有人知道春天何時回歸。
對於小公司而言,寒冬更加難熬。
根據最新的2023半年度財務預告,港股18A雖然出現了幾家盈利企業,但大多數創新藥企在高研發投入之下持續虧損也是不爭的事實。
此外,監管也在持續加壓。
從2021年7月發布的《以臨牀價值爲導向的抗腫瘤藥物臨牀研發指導原則》,到7月27日,CDE“以患者爲中心”指導原則三連發,都是對於新藥研發提高要求,壓縮me too類藥物的生存空間。
在這輪創新藥“去僞存真”、產業升級的過程,創新藥企更加需要“節衣縮食”,用更有效率的方式從激烈的競爭中跑出去。
而幫助小團隊取得關鍵研發突破,盤古藥物大模型已有不少成功案例。
2023年,西安交通大學第一附屬醫院劉冰教授在盤古藥物分子大模型的輔助下,突破性地研發出一款超級抗菌藥Drug X,其有望成爲全球近40年來首個新靶點、新類別的抗生素。
*該藥物通過靶向微生物類組蛋白HU,抑制細菌的DNA復制達到抗菌效果,是世界上首次發現噬菌體編碼靶向細菌類組蛋白HU的抑菌抑制劑。
,時長02:31
盤古藥物分子大模型輔助劉冰教授團隊研發出超級抗菌藥Drug X
據悉,盤古藥物分子大模型的核心能力是精准預測,幫助藥物研究人員在成千上萬的小分子化合物中快速找到可成藥的那一個。
一方面,華爲雲盤古藥物分子大模型採用獨有的“圖-序列不對稱條件自編碼器”架構,把藥物分子結構轉換成可量化的數值,可以更好地在數值空間定量地對藥物分子結構與性質進行預測與推薦。
另一方面,盤古接受了海量的訓練,學習了17億個藥物分子的化學結構,能夠對藥物分子的80多種化合物理化性質進行預測、70多種定向目標進行優化,包括水溶性、吸收、代謝活性、排泄速率、毒性等。
通過全新深度學習架構和超大規模化合物表徵模型訓練,華爲雲盤古藥物分子大模型讓先導藥的研發周期從數年縮短至數月,研發成本降低70%,大幅提升新藥研發效率。
不僅如此,華爲雲盤古藥物分子大模型可生成1億個創新的類藥物小分子庫,其結構新穎性爲99.68%,爲發現新藥創造可能性。
中國生物制藥產業正處於發展初期,存在大量的中小企業,如今AI技術的成熟,不但可以爲Biotech熬過寒冬提供一條可行之路,更加有機會繞开既有壁壘,解決創新藥扎堆問題,走出更多新路。

華爲雲盤古藥物分子大模型,在20余項藥物發現任務上實現性能最優
搭好算法、算力、數據三大基石
在AI滲透到藥物研發的過程中,藥企及機構仍面臨一系列挑战,包括算法低效、數據割裂、數據風險、算力瓶頸等。
因此,強大的算力、精准的算法和高效的數據處理能力,是加速AI藥物研發的“底座”更是關鍵引擎。
算力方面,華爲雲提供醫藥行業分布式雲基礎設施,資源利用率提升40%,支撐百萬級分子對接時間由1個月縮短至1天。可支持大型藥企及CRO在高並發任務處理、異構算力融合、系統穩定性保障等諸多方面的挑战。
算法層面,通過ModelArts平台、盤古藥物分子大模型、藥物研發API,滿足AI藥物研發的多樣化需求,覆蓋藥物設計全流程,在20余項藥物發現任務上實現性能最優。
數據層面,華爲雲通過數據治理生產线DataArts,打破醫藥數據孤島,實現幹/溼實驗數據閉環,激發海量數據價值。
以此三者爲基礎,華爲雲提供一站式AI輔助藥物研發平台,從靶點發現、虛擬篩選、先導化合物優化到獲取可合成的先導化合物,無功能斷點,全流程支撐藥物設計工作。
AI觸發的產業變革正在改變每一個行業,但不能否認的是,一切新生的事物都自有其生長規律,正如目前AI藥物研發仍處於早期應用階段,尚需進一步的臨牀檢驗和驗證。
“種一棵樹最好的時間是10年前,其次是現在。”行業每一輪大變革都依托於突破性技術的革新和賦能,相信有了華爲雲的陪伴,中國生物醫藥的“數智升級”時代會更快到來。
· END ·
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:華爲雲盤古大模型深度賦能:新藥研發從數年縮致數月,成本降低70%!
地址:https://www.breakthing.com/post/84732.html







