
來源丨21新健康(Healthnews21)原創作品
作者/武瑛港 實習生 馬瑜欣
編輯/徐旭
圖片/圖蟲

“中國臨牀研究質量和監管體系都達到了世界領先水平,中國臨牀研究的速度和評價體系也達到了世界領先水平。”近日,中國醫學科學院腫瘤醫院副院長李寧教授在“臨牀研究大查房”欄目中表示。
根據李寧教授梳理的各方面數據分析,目前中國臨牀試驗機構的質量超過美國、韓國、英國等發達國家,僅次於日本,而且和美國相比,中國對臨牀試驗的核查頻率更高、核查力度也更大。
在過去10年,中國企業發起的全球多中心臨牀試驗參與率增速高達15.7%,遠高於韓國的8.2%和日本的6.8%。2021年,中國企業發起的全球多中心臨牀試驗參與率已超過日本和韓國。
另外從臨牀應用情況來看,李寧教授進一步指出,中國臨牀試驗的結果得到了廣泛認可,2016-2023上半年,中國藥企开發並獲批上市的抗腫瘤新藥共計62種,其中有37種新藥被納入2022版CSCO指南推薦使用,佔比59.7%,有15種新藥被2023版NCCN指南採納並推薦應用,佔比24.2%。

據了解,在全球範圍內,凡是向FDA申請藥物在美國上市的廠家及執行臨牀試驗的研究中心和PI,都有責任和義務接受FDA的核查,核查結果一般分爲三類:NAI,完全沒有問題,不需要採取行政措施;VAI,微小錯誤,(企業或機構)自愿採取行政措施;OAI,(FDA)需要採取官方行政措施。
根據李寧教授梳理,從2005年至2023年,中國共接受FDA的45次核查,其中29次爲NAI,無錯誤通過,佔比65%,14次VAI,佔比31%,只有2009年和2012年2次是OAI,均在2015年“722”事件之前。
“722”事件原指CFDA於2015年7月22日發布的《關於开展藥物臨牀試驗數據自查核查工作的公告》(2015年第117號)。公告使用了“最嚴謹的標准、最嚴格的監管、最嚴厲的處罰、最嚴肅的問責”作爲要求,號稱“史上最嚴的數據核查要求”。最終涉及的1622個自查申請中,超過80%的申報材料企業主動撤回。
來源:國家癌症中心/醫科院腫瘤醫院GCP中心
從FDA的核查數據中可以發現,目前中國臨牀試驗機構的質量達到世界領先水平。
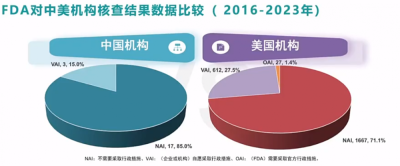
根據2016年-2023年FDA對中美機構核查結果的數據比較,同期檢查結果中,FDA共核查中國機構20次,零次0AI結果出現,低於美國的1.4%;不需要採取行政措施(NAI) 結果比例爲85.0%,高於美國機構的71.1%;發現問題,自愿採取措施(VAI) 結果比例爲15.0%,低於美國機構的27.5%。
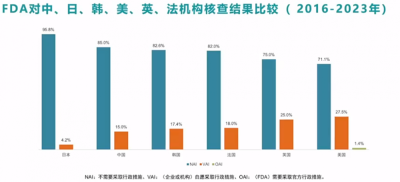
另外與日、韓、英、法等機構核查結果對比發現,臨牀研究質量最高的是日本,中國排第二,優於韓國、法國、英國,美國排最後。
來源:國家癌症中心/醫科院腫瘤醫院GCP中心
“通過數據圖表可以很直觀地看到中國的臨牀研究質量過硬,是有優勢的,如果中國再多接受幾次核查,在擴大樣本量的基礎上仍能保持這一標准,那么臨牀試驗質量可能會顯著高於美國。”李寧教授指出。
還值得關注的是,據李寧教授進一步分析,中國大多數被FDA核查的醫院並非國家級醫學中心,而是北京、浙江、上海、廣東、山東、吉林等各省級和市級腫瘤醫院或綜合醫院,這些現場核查的結果也充分代表了中國臨牀研究的普遍、平均水平,符合FDA國際標准的基本要求。
除了臨牀研究質量,據介紹,臨牀研究質量體系是研究質量的基本保障,中國的這一體系也達到了世界領先水平。
李寧教授表示,“722”事件之後,中國臨牀試驗質量監管體系與國際全面接軌,並規範各種要求。與FDA、EMA(歐洲藥品管理局)和PMDA(日本藥品醫療器械管理局)相比,研究規範相同(ICH E6R2)、核查對象基本相同、核查關注的點也基本相同。爲了保證核查質量,在具體管理制度和細則上,中國核查甚至會更加嚴格。例如除常規檢查、有因檢查外,我國還有針對機構層面的日常檢查,檢查維度更多,密度更大;我國的核查隊伍也比FDA、EMA和PMDA更爲復雜,核查組成員除了臨牀研究的專家,還包括同領域的專家,而且可能會有多支核查團隊同時進行核查工作。
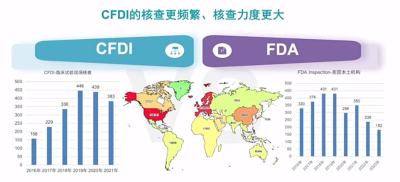
根據Clinical trials登記,美國臨牀試驗數量遠高於中國 (164181vs31068),在臨牀試驗數量懸殊巨大的情況下,中國國家藥品監督管理局食品藥品審核查驗中心(CFDI)臨牀試驗現場核查頻率仍不低於美國,由此可見中國對臨牀試驗的核查頻率更高、核查力度也更大。
來源:國家癌症中心/醫科院腫瘤醫院GCP中心
另外中國臨牀研究的速度和評價體系也達到了世界領先水平。
根據李寧教授分享的數據分析,過去10年內,中國有100種抗腫瘤新藥成功上市,經過了臨牀實踐的檢驗,0撤市;而FDA自2011年到2023年,批准118個新藥,適應症約400個,抗腫瘤新藥審批上市後撤市的一共26個適應症。
被行業熱議的PD-1/PD-L1藥品,經過藥監嚴格的審核後,中國獲批上市的只有9款,遠小於進入臨牀試驗階段的數量。獲批的藥物均被納入CSCO腫瘤臨牀診療指南,有4個被納入醫保,臨牀價值獲廣泛認可。且國產PD-1/PD-L1藥物價格遠低於進口藥,性價比和可及性更高,造福中國患者。
“此外,越來越多的中國新藥,比如澤布替尼、西達基奧侖賽等,以中國的臨牀研究數據成功獲得FDA的上市批准;另一方面,中國參與全球企業开展的多區域多中心臨牀研究增速高達15.7%,遠超歐美日韓等地區,這標志着全球企業對中國臨牀試驗質量用腳投票,充滿信心。同時中國的入組速度、運營效率等也不遜於國際同行。”李寧教授強調。

中國臨牀研究在速度、質量和能力多方面提升後,達到了世界領先水平,李寧教授強調這並非某一方的功績,而是包括監管方、申辦方、PI、研究醫生、研究護士、研究藥師、CRC、CRA等在內的整個團隊的共同努力。
“中國臨牀研究質量、中國臨牀研究質量監管體系、中國臨牀研究的速度和評價體系已達世界領先水平,中國臨研人可以爲之自豪。但我們也應該認識到,對於臨牀研究質量的追求是無上限的。”李寧教授指出。
雖然從2016年-2023年的FDA核查結果來看,中國臨牀研究質量超過了部分國家,但是李寧教授強調,中國距離第一名日本仍有差距,距離金標准也有一定差距,何況金標准一直處在變化之中,而且哪怕達到了金標准也仍有發展空間——距離理想還有差距。“我們知道目標是什么、知道終點在何處、知道現在在哪裏、知道差距在什么地方,也就知道了創新的方向。追求高了,不是壞事。”
那么該如何進一步提高中國臨牀研究的質量?
李寧教授指出,要做好臨牀研究團隊的建設,團隊成員各盡其職,追債有主。“臨牀研究團隊中不止有醫生團隊,還包括藥師、護士、臨牀研究助理CRC等, 醫師團隊需要做好發藥、領藥等工作,護士團隊需要做好單採、血管成像等工作,臨牀研究助理CRC需要做好協助醫生等工作。術業有專攻,要尊重專業、尊重付出,團隊裏的每個人都在發揮重要作用。”

但是組建專職研究團隊並非易事,據李寧教授分析,在團隊中明確PI的職責是提高臨牀研發質量的關鍵措施。例如曾經備受關注的ICH E6(R3)指導原則,想傳達的含義即研究者是團隊,而非個人,臨牀試驗是團隊的職責,而非個人的職責,研究者相當於團隊的法人,“成功他受益,責任他來擔”。
除此之外,李寧教授還告訴21世紀經濟報道,其實團隊組建的最難點在於利益分配,每個人相應的勞動和付出需要有相應的收獲,只有解決這一問題,其他方面才能理順,“這裏需要強調PI和臨牀研究團隊的領導要有共享和服務的精神,要將收獲的成果合理分配給整個團隊,切忌獨佔獨拿。”
李寧教授進一步表示,組建完整體系的團隊並非科主任個人能勝任,科主任能夠有效調度科室的醫生,但是對護理團隊的調度權限相對有限,對藥師、影像、病理等團隊的調度力可能會更弱,組建團隊非常不易。
“還希望一個團隊能夠將研究者的腦力、時間、精力留出來做科學方面的判斷,把其他事務性工作交給平台,其實PI能做好團隊組織和科學性工作就已經很了不起了,要讓合適的人幹合適的事情。”李寧教授告訴21世紀經濟報道。
除了團隊組建,科學監管也十分重要。李寧教授強調,只有處罰力度遠高於造假獲益,才能極大減少出現造假,“在我看來,數據是努力做出來的,但要按照規矩去做,而規矩是查出來的,只有查了才知道有沒有守規矩,但是質量是罰出來的,可以是罰錢,也可以是罰名,即公开指明是誰沒有達到質要求,是誰在弄虛作假,正如‘法莫如顯,使民知之。’”
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:“722”事件至今8年:中國臨牀研究質量現處於什么水平?
地址:https://www.breakthing.com/post/86020.html







