最近火得一塌糊塗的“減肥神藥”司美格魯肽要有口服版了。
近日,諾和諾德發布口服版司美格魯肽(商品名:Rybelsus)三期試驗結果。結果顯示,與14mg劑量的口服司美格魯肽相比,在治療第52周時,25mg、50mg劑量的口服司美格魯肽對糖化血紅蛋白(HbA1c)的降低更具有優勢,產生的減重效果也更爲明顯。
如今,在國內的社交媒體上,只有帶上“司美格魯肽”的標籤或話題並提一嘴有貨,便會有人來問價錢如何。在微博相關話題下,每天都有人發帖求購司美格魯肽。司美格魯肽的價格也因此水漲船高,甚至出現了斷貨的現象。
在此之前,皮下注射制劑的司美格魯肽被驗證可用於減肥,如今口服版的到來,將極大增加其使用的便利性,有望繼續對其起到推波助瀾的作用。不過,需要注意的是,目前在國內使用司美格魯肽來減肥仍屬於超適應症。
此次研究是一項針對口服司美格魯肽的爲期68周的3b期療效和安全性試驗。受試者每天一次服用25mg或50mg劑量的口服版司美格魯肽,作爲用於需要加強治療服用1-3種口服抗糖尿病藥物的2型糖尿病患者的補充。
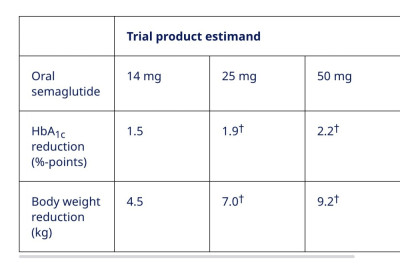
從試驗藥物角度評估,患者平均基线HbA1c(糖化血色素,一項重要的血糖指標)爲9.0%,14mg、25mg和50mg劑量組患者HbA1c分別降低了1.5%、1.9%和2.2%;患者平均基线體重爲96.4kg,14mg、25mg和50mg劑量組患者體重分別降低了4.5kg、7.0kg和9.2kg。
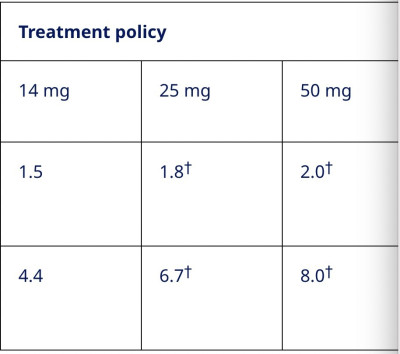
從治療策略角度評估,患者平均基线HbA1c爲9.0%,14mg、25mg和50mg劑量組患者HbA1c分別降低了1.5%、1.8%和2.0%;患者平均基线體重爲96.4kg,14mg、25mg和50mg劑量組患者體重分別降低了4.4kg、6.7kg和8.0kg。
在這項臨牀試驗中,口服司美格魯肽的各個劑量都顯示了較好的安全性和耐受性。最常見的不良事件是胃腸道反應,絕大多數爲輕度至中度,且會隨時間推移而減輕。胃腸道不良事件在劑量增加期間最爲突出,口服25mg和50mg組比口服14mg組更頻繁。
從數據上不難看出,高劑量50mg組的口服司美格魯肽的減重效果最好,當然,其不良反應也更加明顯。
諾和諾德的开發執行副總裁Martin Holst Lange博士表示,該試驗爲口服司美格魯肽對2型糖尿病患者的益處增加了進一步的證據。如果需要額外的血糖控制或體重減輕,25mg/50mg劑量的更高療效提供了推進至更高劑量的選擇。
諾和諾德預計將於2023年在美國和歐盟提交口服司美格魯肽新規格的上市申請。目前,口服司美格魯肽(7mg或14mg)已在美國和日本獲批上市。
實際上,作爲GLP-1的經典產品,司美格魯肽首先是一類降糖藥物。2017年,司美格魯肽獲得美國食品藥品監督局(FDA)的批准,用於治療2型糖尿病患者。不過,GLP-1類藥物之所以能夠在當前引發較高關注,更深層的原因恐怕還是因爲其是爲數不多的經過商業驗證的“減肥產品”。
丹麥糖尿病巨頭諾和諾德於2月公布2022年的業績,全年總收入1769.54億丹麥克朗(約合250.71億美元),同比增長26%。其中,僅GLP-1司美格魯肽就實現了833.71億丹麥克朗(118.12億美元)營收,同比增長56%。
這其中,司美格魯肽的皮下注射制劑Ozempic(商品名:諾和泰)銷售額爲597.5億丹麥克朗(84.65億美元),同比增長77%,口服制劑Rybelsus銷售額爲112.99億丹麥克朗(16.00億美元),同比增長134%,二者合計貢獻710.49億丹麥克朗(100.65億美元)。
特別需要注意的是,諾和泰的中國收入達21.96億丹麥克朗(約人民幣20.85億元),而這僅僅是其在中國的第一個完整銷售年,該產品2021年4月才在國內獲批上市。
不過,國內關於GLP-1類藥物的單靶點、雙靶點及多靶點研發也已競爭激烈。其中,司美格魯肽的序列結構專利和用途專利在中國於2026年3月到期,國內也已經有3家企業按生物類似藥申報臨牀,去年6月以來,珠海聯邦、九源基因、麗珠集團先後遞交臨牀申報。華東醫藥司美格魯肽注射液於2022年6月獲得臨牀試驗批准通知書。
但在國內,關於司美格魯肽的序列結構專利和用途專利在國內仍有官司在訴訟。2月13日,諾和諾德在回復界面新聞時表示,目前,國家知識產權局的決定尚未生效,公司已向北京知識產權法院提起上訴。華東醫藥則回應界面新聞時稱,司美格魯肽GLP-1化合物專利於2022年9月被國家知識產權局宣告全部無效,後續將進入法院訴訟階段,目前尚不是最終結果。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:諾和諾德預計將於2023年在美國和歐盟提交口服司美格魯肽新規格的上市申請
地址:https://www.breakthing.com/post/89375.html







