近年來,中國醫療器械行業在政策的推動下呈現出強勁的發展勢頭。許多國產廠家已經开始在技術創新、產品質量等多方面展現出與國際頭部醫療器械企業長期匹敵,甚至超越的競爭優勢。國產廠家的崛起,使中國醫療器械走向全球市場水到渠成。
近日,健世科技宣布,其自主研發的經導管三尖瓣置換系統,獲選加入美國食品藥品監督管理局(FDA)的產品全生命周期咨詢計劃(TAP),將有效加速其在美國的臨牀試驗和商業化拓展進度。
公告發出後,健世科技开盤一度上漲超14%,直觀地反映出市場對於健世科技的經導管三尖瓣置換系統LuX-Valve系列產品的認可以及公司未來發展的信心。
1、創新性、臨牀價值獲認可,出海進程再提速對於健世科技而言,經導管三尖瓣置換系統進入TAP是其獲得FDA授予突破性器械認定後的又一大裏程碑事件,將進一步加速其在美國的臨牀和商業化進展。
簡單來說,TAP旨在通過促進FDA與醫療器械廠商之間早期、頻繁和战略性的溝通,以確保美國患者能夠於未來幾年內在全球範圍率先獲得高質量、安全、有效和創新的醫療器械。截止至2023年9月8日,FDA在TAP試點中僅納入了9款器械。
不難判斷,健世科技的經導管三尖瓣置換系統能夠獲納入TAP,一方面意味着產品的創新性,以及在治療方面的安全性和適用性已經獲得權威標准的認可,擁有值得期待的競爭優勢。另一方面,FDA也將從战略和執行兩個層面提供持續的支持,推動該產品後續在美國的臨牀和商業化進程。

資料來源:公司資料
更深層次地來看,作爲一款爲治療重度三尖瓣反流及高手術風險患者設計的產品,LuX-Valve系列產品成功獲得FDA授予的突破性醫療器械認定和獲選納入TAP,且臨牀資料已被歐洲心髒病學會(ESC)和歐洲心胸外科協會(EACTS)瓣膜性心髒病管理指南所引用,標志着中國國產醫療器械在國際標准引領方面取得了重大進展。健世科技的經導管三尖瓣置換系統的成功經驗亦是爲其他中國醫療器械企業提供了借鑑,將有力推動中國醫療器械產業的發展和國際競爭力的提升。
此外,一代產品LuX-Valve及二代產品LuX-Valve Plus均已進入NMPA創新醫療器械特別審查程序,多項國內外認可的資質更是直接彰顯出健世科技在介入醫療器械方面強勁的技術實力。
目前,LuX-Valve已進入NMPA注冊審評階段且注冊發補資料已遞交國家藥監局,有望成爲全球首批上市的三尖瓣置換介入治療產品。若LuX-Valve順利於今年第四季度在中國如期上市銷售,後續其也將爲該產品在美國及其他海外地區的商業化提供更多數據支撐,加速在美國的臨牀試驗和商業化進程。
2、走出去到全球化,清晰的全球化战略透過健世科技這一動態回到行業視角上,不由得引發出一個問題,國產醫療器械爲什么要出海?
投資領域有一句話,"不做中國市場做不大,不做全球市場做不強。"歸結爲一句話,那就是國產醫療器械廠家出海是發展壯大的必經之路,並將爲國內醫療器械公司在多變的環境下提高抗風險能力。我們不妨從以下三個方面來看:
其一,海外醫療器械市場空間廣闊。西南證券指出,目前全球器械市場主要由美國和歐洲貢獻,預計後續以中國爲主的亞太市場、以及拉美、中東、非洲等發展中國家市場增速將快於發達市場,國內器械出海進可攻發達市場,退可守發展中國家市場。
以全球結構性心髒病介入醫療器械市場爲例,弗若斯特沙利文預計,全球結構性心髒病介入醫療器械市場規模將由2021年的93億美元增至2025年的198億美元,年復合增長率爲20.8%,並於2030年增至481億美元。
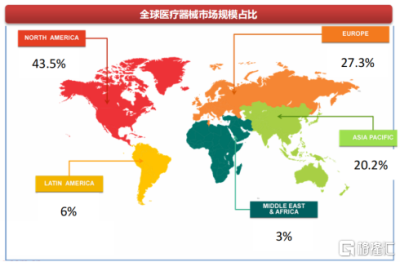
資料來源:西南證券
其二,海外市場具有多元化的購买方結構,以商業保險爲主,這與國內單一的支付方模式形成鮮明對比。這種支付結構使整個產品價格體系更爲穩定,並且隨着產品的不斷創新和迭代,部分產品的價格逐漸趨於穩定甚至略有提升。以TAVR爲例,愛德華的Sapien系列自2011年在美國上市以來,單價基本維持穩定。
其三,海外市場受經濟發展水平、醫療保健政策、健康意識以及醫療器械技術等多方面因素作用影響,如北美、歐洲等發達地區有着較強的商業保險支付能力以及患者支付意愿。
順應這一必然趨勢,健世科技作爲一家深耕結構性心髒病介入治療領域的醫療器械企業,已形成了一套清晰的全球化战略。目前,公司同時推進自研產品在歐洲、北美、亞太等地區的國際化布局,旗下產品已在全球超過10個國家或地區擁有164項已授權專利及196項專利申請。
以三尖瓣置換產品爲例,除前文提及的LuX-Valve以外,公司的二代三尖瓣置換產品LuX-Valve Plus也同樣在海外市場取得了積極進展。
在北美市場,已在美國及加拿大地區完成數十例臨牀植入,持續推進經導管三尖瓣置換系統產品在北美地區的臨牀及商業化進程。預計在今年內正式進入EFS和IDE臨牀試驗階段。
在歐洲方面,持續在歐洲進行以獲取CE認證爲目標的臨牀應用。已經在法國、德國、西班牙、意大利、丹麥等歐洲主要國家及地區开展數十例臨牀植入,取得多國專家的一致好評。
在亞太區域,已成功开展多例收費同情救治使用,進一步提升公司在亞太地區的學術地位和商業化影響力。
可以預想,未來公司的收入將呈現多產品、多國家、多區域均衡分布的局面,以適應細分市場和多樣化的消費者需求,獲取更多收益。同時積極拓展國際市場和不同地區業務,也將提高公司的市場佔有率和競爭力,從而實現持續、穩定的發展。
從競爭格局來看,目前全球還未有一款三尖瓣介入置換治療產品獲批上市,相較於全球已經進入確證性臨牀試驗階段的三尖瓣介入置換產品,健世科技的LuX-Valve系列無論是在技術理念、臨牀進度和臨牀效果上,均有着領先優勢。
值得一提的是,LuX-Valve系列產品作爲一款中國自主創新研發的第三類醫療器械,其研發過程相當漫長,從立項、臨牀試驗到預期拿證,歷經10年。而健世科技憑借着前瞻性的布局,力克三尖瓣介入置換的高技術門檻,推動LuX-Valve邁入商業化的最後階段,即將獲批上市搶跑市場。
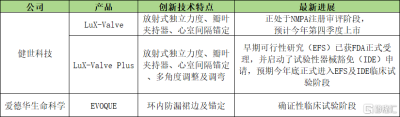
資料來源:公开資料
此外,健世科技的其他管线臨牀也在穩步推進中。例如,經導管主動脈瓣置換系統Ken-Valve已於今年上半年完成確證性臨牀試驗的一年隨訪工作,即將向NMPA提交注冊,預計2024年下半年獲批上市,有望成爲中國第二款、全球第三款能夠治療主動脈瓣重度關閉不全(或合並狹窄)的主動脈瓣介入治療產品。經導管二尖瓣修復系統JensClip確證性臨牀試驗入組已將近過半。經導管二尖瓣瓣葉增強系統JensFlag已成功完成數例人體應用,驗證了二尖瓣瓣葉增強技術的可行性。其全資子公司迪創醫療孵化的房間隔造孔支架系統MicroFlux和左心耳封堵器系統SimuLock亦均進入到正式FIM臨牀試驗入組階段,當前入組均順利成功。

資料來源:公司資料
3、小結"出海"作爲企業能否在行業中走得更遠的關鍵,已成爲國產醫療器械廠家的追求目標。但海外市場存在空白的臨牀需要,自身產品力的強大,公司過硬的綜合能力(持續的創新研發能力、穩定的質量體系、前瞻性的全球布局眼光)仍是擺在許多國產醫療器械尋求出海目標所必須面對和解決的。
健世科技持續不斷的創新研發升級出三尖瓣置換系統LuX-Valve、LuX-Valve Plus,以及主動脈瓣置換系統Ken-Valve等多個極具競爭力的醫療器械,展現出公司在行業中的先發優勢和獨特競爭力,爲其瞄准全球市場的國際化布局奠定堅實的基礎。
反映到估值層面,筆者認爲,隨着市場情緒逐漸回歸理性,LuX-Valve及更多產品上市兌現業績,可以靜待健世科技的價值升維。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:經導管三尖瓣置換系統獲選進入TAP,健世科技(9877.HK)全球化战略步伐再提速
地址:https://www.breakthing.com/post/98801.html







