隨着全球人口老齡化的不斷加劇,帶狀皰疹日益成爲了影響老年人生活質量的疾病,預防老年人罹患帶狀皰疹的疫苗也逐漸成爲了增進民衆健康的不二之選。
根據弗若斯特沙利文數據,按銷售收入計算,中國帶狀皰疹疫苗市場有望在2030年迎來285億的大市場。目前國內帶狀皰疹疫苗市場是雙寡頭格局,只有GSK的Shingrix和百克生物的感維獲批上市。
注意到,該賽道的資本市場新貴綠竹生物-B(02480.HK)也參與了帶狀皰疹疫苗研發,從研發進度和技術路徑來看,綠竹生物是國內重組帶皰疫苗臨牀進展最快、已披露數據最好的一家,競爭潛力不容小覷。
公开資料顯示,綠竹生物已在9月28日宣布正式啓動重組帶狀皰疹疫苗LZ901的三期臨牀研究,該疫苗也是除Shingrix外全球第二家進入三期臨牀研究的重組帶狀皰疹疫苗。若綠竹生物產品最終上市,將帶給市場多大的衝擊?本文將從技術路线、臨牀進度、臨牀數據、出海情況等方面來進行分析。
技術路线:重組蛋白路线保護率更優
重組疫苗、減毒活疫苗與RNA疫苗,是目前帶狀皰疹疫苗研發的三條主流技術路线。
最早上市的減毒活疫苗,由於其較低的保護效率、較短的保護期限,逐漸被重組蛋白疫苗所替代。而RNA技術路线的帶狀皰疹疫苗,由於其新技術面世時間不長,仍需長時間驗證。
重組帶狀皰疹疫苗的主流地位從兩方面表現:其一,Shingrix壟斷全球市場,在其上市後第三年(即2020年11月),減毒疫苗Zostavax不再於美國售賣。2022年,Shingrix在全球的銷售額約爲36億美元。2023年,GSK披露第二季度財報顯示,Shingrix銷售額同比增長20%,僅半年時間就銷售高達約22億美元。其二,目前處於臨牀階段的其他在研的帶狀皰疹疫苗大都選擇重組蛋白路线,說明其市場認可程度高。
臨牀進度:綠竹生物斷檔式領先
從國內公司競爭格局來看,綠竹生物的技術路线是重組蛋白路线,已於2023年9月進入三期臨牀研究,研發進度斷檔式領先。
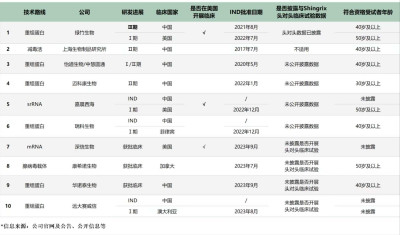
據綠竹生物9月28日公告披露,其已於江蘇、山東、湖北和山西等四個省份啓動了其核心產品LZ901的多中心、隨機、雙盲、安慰劑對照設計,用於評價在40歲及以上成人中預防帶狀皰疹保護效力、安全性的三期臨牀試驗,總入組規模約2.6萬人,截至公告日已完成首批受試者入組。
臨牀數據:安全性和免疫原性優秀
LZ901是綠竹生物自主研發的在研重組帶狀皰疹疫苗及核心產品,爲全球首款具有四聚體分子結構的帶狀皰疹疫苗。
與天然存在的VZV抗原相比,其分子結構具有雙倍的Fc區供抗原呈遞細胞(APC)結合,LZ901主動向免疫細胞呈遞VZV抗原以觸發免疫反應。此外,LZ901在臨牀前研究中表現出高免疫原性和安全性,同時誘導出特異性體液和細胞免疫。
與Shingrix相比,LZ901的具備以下優勢:
首先,副作用小。誠如LZ901在中國的一期和二期臨牀試驗安全性數據證明,施用LZ901的受試者的一級至三級AE的總體數量和發生率均遠低於施用Shingrix的受試者。且Shingrix海外三期臨牀數據顯示其總體三級不良反應率超過20%,而LZ901目前二期臨牀數據顯示其疫苗組三級不良反應率僅爲1%。
此外,該公司採用的劑型爲方便易用的液體制劑。綠竹生物在研重組帶狀皰疹疫苗LZ901採用了高度穩定的液體制劑配方,可以方便地儲存和運輸。它在37C下可穩定兩周,在25C下穩定12周,在2-8C下可穩定的存放24個月以上。由於液體制劑只含有常規使用的氫氧化鋁佐劑,不含免疫刺激物,減少了注射部位發生嚴重不良反應的可能性,因此,施用LZ901的副作用很小。
其次,強保護。根據從LZ901在中國的一期臨牀試驗所收集的免疫原性數據,其證明與Shingrix相比,在全程接種LZ901後,抗VZV抗體水平並無顯著差異。而且,LZ901誘導更強細胞免疫反應,對帶狀皰疹應有很強的保護作用。在人體頭對頭試驗中,與Shingrix相比,LZ901誘導更強的細胞免疫反應,輔助T細胞(CD4+)及細胞毒性T細胞(CD8+)表達多種類型的免疫細胞啓動生物標志物的細胞比例更高。這表明LZ901在誘導細胞免疫方面不弱於Shingrix,LZ901提供強大的帶狀皰疹保護。
值得一提的是,LZ901定價更具競爭力。與Shingrix全程接種約3200元的定價相比,LZ901的定價將更適合中國國情,更具有性價比。國內按照批籤發口徑計算GSK帶狀皰疹疫苗滲透率僅爲0.3%左右,滲透率提升空間較大。
出海情況:第一家中美同時臨牀的疫苗 兩地上市增量空間可期
在出海大趨勢下,國內創新藥企們陸續嘗試了海外授權(license out)等多種出海模式。隨着出海經驗積累,在中美兩地同時展开臨牀試驗這一新模式逐漸在創新藥企中流行。
今年2月,綠竹生物在美國紐約啓動重組帶狀皰疹疫苗LZ901的一期臨牀研究,是該賽道內國內首個在中美兩地同時進行臨牀研究的企業。到目前爲止,也仍然是唯一獲得FDA批准臨牀的國產重組帶皰疫苗。
同時據綠竹生物9月28日的公告披露,其近日已於日本取得LZ901的發明專利注冊。除美國、歐洲、英國、韓國、加拿大、澳大利亞的在申請專利外,綠竹生物已獲得中國、俄羅斯和日本的專利批准。
認爲,綠竹生物加速出海,是順應行業發展趨勢的舉措,也是國產疫苗創新的一個重大裏程碑。一方面,國內的醫保定價體系正在倒逼創新藥企出海以獲取更大利潤空間;另一方面,Biotech企業們要打开估值空間,出海也是必然要走的路徑。而企業一旦決心要出海,作爲全球最大醫藥市場的美國必然是繞不過去的。因此,綠竹生物作爲出海先行者,反映了綠竹生物是以全球藥物开發的視角來研發藥物,更表露出其全球化布局的雄心。
若能順利在全球市場上市,綠竹生物的增量空間值得期待。以Shingrix爲例,帶狀皰疹疫苗Shingrix 2022年全年實現銷售收入36億美元,中國、德國市場同比增長超過100%,刷新了自上市來的銷售記錄。GSK認爲Shingrix在2026年的銷售收入有望超過40億英鎊。
綠竹生物重組帶皰疫苗臨牀進展再進一步,則意味着其研發穩步推進,產品向市場化腳步加快。此外,公司產品不僅效果出衆且價格極具競爭力,若順利上市,將顛覆這一產業競爭格局。創新藥的投資邏輯在於技術卡位,從這一點來看,綠竹生物的價值巨大。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:綠竹生物(02480):重組帶狀皰疹疫苗LZ901啓動三期臨牀研究 帶狀皰疹疫苗市場競爭迎新曙光
地址:https://www.breakthing.com/post/100457.html







