高端流感疫苗三期收案不全?食藥署:在台臨牀試驗非必要
1年前

高端流感疫苗三期收案不全?食藥署:在台臨牀試驗非必要
高端流感疫苗近期再度引發爭議,國民黨質疑,高端在台灣執行的第三期臨牀試驗並未完整針對各年齡層收案,對其安全性與效益存疑。對此食藥署今(18)日於例行記者會說明,高端公司提供的疫苗原液原廠資料中,已經涵蓋亞洲人種,足以確認其療效與安全性,在台臨牀試驗並非必要。我是廣告 請繼續往下閱讀 國民黨立委王鴻薇昨(17)日質疑,高端流感疫苗在台灣執行的第三期臨牀試驗,並沒有未收案20歲以下、50歲以上民眾,而衛福部認為,相關資訊屬於商業機密,因此拒絕公開南韓GC公司的臨牀數據,恐難取信於民眾。
高端公司今年所提供的流感疫苗,為該公司購買「GC Biopharma四價流感疫苗」原液後分裝製成,而GC公司所生產的該流感疫苗具有世界衛生組織(WHO)及韓國認證。
高端公司昨日亦表示,醫藥品在不同國家的審查皆是以「原廠數據」或加上「當地代表性族群的數據」銜接為主,WHO PQ也沒有要求在全球流通GC Biopharma流感疫苗的63國家進行「重複相同而無實質意義」的臨牀試驗。
食藥署副署長陳惠芳則指出,跨國疫苗廠會因應不同地區的性質,採取原液分裝充填的作法,除非充填後的品質與原來不同,否則提供給主管機關審核的數據都是同一組。
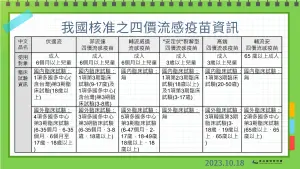
此外,高端四價流感疫苗查驗登記方面,陳惠芳說明,該公司檢附臨牀資料包括韓國執行第一、二期及第三期臨牀試驗,受試者年齡包括3至18歲、19歲以上及65歲以上等,也在台灣執行第三期臨牀試驗,受試者年齡為20至50歲。
陳惠芳說,疫苗產品與其他西藥藥品不同,與人種其實沒有太多的關聯性,但跨國疫苗大廠在做臨牀試驗時,通常會設計為多國、多中心,避免查驗登記時,被要求再針對其他需求重複執行臨牀試驗。
針對高端一案,陳惠芳表示,該公司原廠於韓國進行的臨牀試驗,已經有涵蓋亞洲人種資料,評估與台灣無族群差異,且國外數據已經足夠完整,所以其實可以直接申請許可證,在台灣執行臨牀試驗並非必要。
另一方面,目前台灣核准的6款流感疫苗中,包括GSK、賽諾菲等,除國內臨牀試驗外,也有使用國外臨牀試驗,東洋的兩款流感疫苗,則都沒有國內臨牀試驗、全採國外多國多中心的臨牀試驗作法,僅有國光疫苗完全在台灣執行三期臨牀試驗。
股價重挫!高端控醫師王任賢散布流言影響股價 不起訴確定
巷仔內/昨日國光、今日高端!國產疫苗慘案又重演
11個月大男嬰染流感!併發心、肺重症 發病到死亡僅3天
桃園稱「校園沒高端流感疫苗需求」 公司:盼聽到不一樣聲音
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:高端流感疫苗三期收案不全?食藥署:在台臨牀試驗非必要
地址:https://www.breakthing.com/post/104113.html






