
PI3K/AKT/mTOR是腫瘤發生的經典通路,PI3K從被發現至今,已近四十年,PI3K作爲一個被衆多科學家長期關注和研究的成熟靶點,同樣也受到資本市場熱捧,其研發動態也被衆多制藥人實時關注着。而就在2022年7月,全球PI3K抑制劑研發格局又有新的變化:
PI3K/mTOR雙重抑制劑獲FDA突破性療法認定,治療晚期乳腺癌
日前,Celcuity公司宣布,美國FDA已經授予其潛在“first-in-class”PI3K/mTOR抑制劑gedatolisib突破性療法認定,用於治療HR陽性/HER2陰性轉移性乳腺癌患者,她們在接受過CDK4/6抑制劑和非甾體芳香酶抑制劑治療後疾病出現進展。Gedatolisib是一款選擇性靶向所有I型PI3K異構體和mTOR的雙重抑制劑。它的作用機制和藥代動力學特徵具有高度差異性。與異構體特異性 PI3K抑制劑或mTOR抑制劑相比,同時抑制所有4類I型PI3K異構體和mTOR限制了潛在耐藥性的產生。據藥融雲數據庫顯示,Gedatolisib目前針對轉移性乳腺癌在美國的試驗已推進到臨牀2期。
Gedatolisib適應症研發詳情
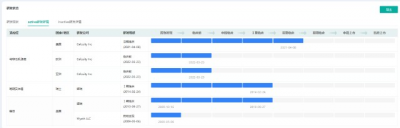
截圖來源:藥融雲全球藥物研發數據庫
甫康藥業收購一款PI3K/雙重抑制劑全球權益
13日,甫康(上海)健康科技有限責任公司宣布,其與英國公司Karus Therapeutics籤署收購協議,獲得了一款磷酯酰肌醇-3-激酶/雙重高選擇性抑制劑——CVL237(KA2237)的全球專利、开發及商業化權益。該藥是Karus Therapeutics自主研發的口服制劑小分子藥物,目前針對B淋巴細胞瘤的臨牀試驗進展最快,已推進到一期。
KA2237醫藥交易信息
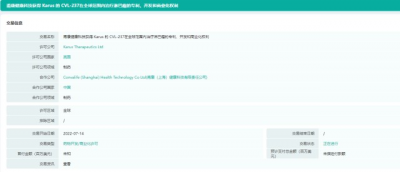
截圖來源:藥融雲全球醫藥交易數據庫
但是,每一枚硬幣都有兩面性,PI3K抑制劑的研發也不例外,有喜訊傳來就有噩耗爆出。2022年截至目前,全球已有4條撤市(打回)申請,其中三條都是在已經上市的藥物:
1月,吉利德自愿撤回Idelalisib用於治療FL和SLL的適應證,Incyte宣布將撤回PI3K抑制劑Parsaclisib在美國的新藥上市申請;
2月,拜耳自動撤回了其PI3K抑制劑Copanlisib在中國的一項適應症上市申請;
3月,美國FDA打回MEI Pharma的Zandelisib上市申請;
4月,TG Therapeutics自愿撤回其Ukoniq(Umbralisib)聯合Ublituximab治療慢性淋巴細胞白血病和小淋巴細胞淋巴瘤成人患者的生物制劑許可申請/補充新藥申請。
究其原因,主要在於PI3K抑制劑的高毒性,例如臨牀研究中發現idelalisib在聯用其他靶向或化療藥物在一线或二线中,出現了免疫介導的毒性和感染性並發症,其他已獲批上市的PI3K抑制劑也或多或少存在安全性問題。
一、PI3K的發現
1984年學者發現一條新的信號通路,其與病毒癌基因編碼酪氨酸激酶的活性密切相關;1988年Cantley和Downes團隊發現這種病毒相關的激酶就是磷脂酰肌醇-3-磷酸激酶,可以磷酸化肌醇環中的3-OH產生磷脂酰肌醇-3-磷酸。這條由脂質激酶組成的信號通路隨後被定義爲PI3K信號通路。
在後續的基礎研究中,學者們還發現PI3K信號通路下遊的基因,包括AKT、mTOR等,我們稱之爲PI3K/AKT/mTOR信號通路。這是胞內最重要的信號通路之一,主要負責調控細胞生長、增殖及遷移等細胞生物學功能。目前爲止,發現在多種腫瘤組織中PI3K/AKT信號通路過度表達和活化與腫瘤的發生發展密切相關,包括肝癌、非小細胞肺癌、胃癌、前列腺癌、膀胱癌以及乳腺癌等。不僅在許多實體腫瘤中,在血液系統腫瘤中,PI3K信號通路經常是被下調的,文獻報道PI3K的突變可發生於多個瘤種,總體突變發生率約爲10%-46% ,且攜帶PI3K突變的患者生存預後更差。由於其在癌症發生和進展中起重要作用,PI3K已成爲研究人員开發癌症靶向藥的熱門靶點之一。
PI3K根據其結構和底物的特異性不同可分爲Ⅰ型、Ⅱ型和Ⅲ型3類。其中,Ⅰ型PI3K是目前研究最深入的亞型。根據結合亞基的不同,Ⅰ型可分爲ⅠA型和ⅠB型。其中ⅠA型由受體酪氨酸激活,可分爲PI3K、PI3K和PI3K,其催化亞基分別是p110、p110、p110,ⅠB 型PI3K催化亞基主要爲p110,其中編譯 PI3K的基因PI3CA是腫瘤中最常見的突變。
二、全球PI3K抑制劑靶向藥市場
經藥融雲數據庫查詢,目前全球已有5款PI3K抑制劑靶向藥被批准用於淋巴癌和乳腺癌的治療,分別爲諾華的alpelisib(PI3K)、吉利德的idelalisib(PI3K)、Verastem Oncology的duvelisib(PI3K、PI3K)、拜耳的copanlisib(pan-PI3K)和TG Therapeutics的Umbralisib(已撤市),除Copanlisib外,其余均爲亞型選擇性抑制劑。
全球已上市的PI3K抑制劑靶向藥

截圖來源:藥融雲全球藥物研發數據庫
據藥融雲統計,在以上已上市的PI3K抑制劑靶向藥裏,諾華的alpelisib商業化效果最好,處於PI3K抑制劑市場的主導地位。該藥於2019年5月首次在美國獲批上市,第一年的銷售額就突破了一億美元,2020年銷售3億美元,2021年漲幅不大,但總體依舊保持增長趨勢。
alpelisib全球銷售情況

截圖來源:藥融雲全球藥物研發數據庫
而在國內市場,在今年才有一款PI3K抑制劑靶向藥獲批上市:2022年3月,石藥集團度維利塞膠囊(duvelisib)獲批上市,用於治療以往至少經過兩次系統性治療的復發或難治性濾泡性淋巴瘤(r/r FL)成年患者。早先在2018年9月,石藥集團就與Verastem Oncology籤訂協議,獲得度維利塞在中國的獨家權益。據藥融雲全球醫藥交易數據庫顯示,作爲獨家特許權的代價,石藥集團將向Verastem支付預付款項1500萬美元(約1.03億元人民幣)及开發裏程碑費最多3000萬美元(約2.06億元人民幣),裏程碑費與預付款合計共3.09億元人民幣。
duvelisib醫藥交易信息
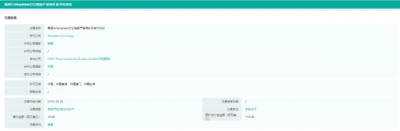
截圖來源:藥融雲全球醫藥交易數據庫
據悉,度維利塞最早於2018年9月在美國首發上市,獲批適應症爲慢性淋巴細胞白血病、濾泡中心淋巴瘤,是全球首個獲批的磷脂醯肌醇-3-激酶PI3K-和PI3K-口服雙重抑制劑,也是在中國首家且目前唯一獲批的PI3K選擇性抑制劑。
度維利塞全球上市時間軸(部分)
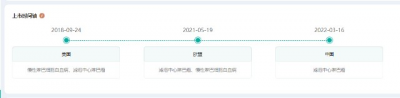
截圖來源:藥融雲全球藥物研發數據庫
三、全球PI3K抑制劑研發格局
根據藥融雲數據統計,目前全球共有335款PI3K抑制劑在研,涉及100余家企業,其中爲研發活躍狀態的佔比僅爲49.55%,其余均爲“研究終止”、“研究暫停”或“無後續進展報道”,乳腺腫瘤、非霍奇金淋巴瘤、慢性淋巴性白血病等爲全球在研企業關注的熱門適應症。
PI3K抑制劑研發格局:適應症TOP10
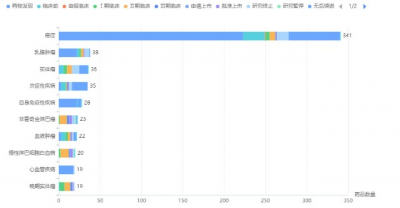
截圖來源:藥融雲全球藥物研發數據庫
另外,值得一提的是恆瑞醫藥/瓔黎藥業的PI3K抑制劑靶向藥——林普利司已經在國內以1類新藥遞交了上市申請,並於2021年5月被CDE承辦,且被納入了優先審批(適用於既往接受過二线或二线以上全身系統治療的復發或難治濾泡性淋巴瘤患者的治療)。若順利獲批,這將會成爲國產第一款獲批上市的PI3K抑制劑靶向藥。
林普利司上市申請信息
截圖來源:藥融雲中國藥品審評數據庫
其他PI3K抑制研發進展較快的還有羅氏inavolisib、優時比seletalisib、先聲藥業rigosertib sodium、阿諾生物醫藥buparlisib、信達生物parsaclisib、諾華leniolisib、協和發酵麒麟zandelisib等。
結語:
目前全球PI3K抑制劑研發格局復雜多變,臨牀試驗也正如火如荼地开展着,還有不少藥企正在調研、觀望,或准備出手布局,但不得不說的是,在投入的同時,也不可忽視其抑制劑的高毒性,因爲這對PI3K抑制劑的臨牀應用來說,無疑是一項巨大的挑战。隨着相關研究的深入,未來該靶點安全性問題是否能得到解決,未來將重新突圍抑或面臨更嚴格監管?讓我們拭目以待。
<END>
- 諾華制藥(NVS)
- 石藥集團(01093)
- 恆瑞醫藥(600276)
- Celcuity LLC(CELC)
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:P13K抑制劑研發格局!石藥集團拿下國內首款、恆瑞醫藥或將上市
地址:https://www.breakthing.com/post/15083.html







