
10月18日,科濟藥業宣布,其全人抗自體CAR-T產品澤沃基奧侖賽的新藥上市申請(NDA)已獲CDE受理,用於既往接受過至少一種免疫調節劑和蛋白酶體抑制劑治療失敗的復發或難治性多發性骨髓瘤(R/R MM)成年患者。此外,該適應症已於10月13日被納入擬優先審評名單。這也是國內第2款申報上市的BCMA CAR-T產品。  多發性骨髓瘤(MM)是第二大常見的血液系統惡性腫瘤,骨髓中的漿細胞失去控制的增長,並產生異常蛋白,從而導致包括心髒和腎髒等重要器官受損。根據世界衛生組織的資料,2020年中國有超過21000例MM新病例和近16200例MM死亡病例。盡管患者可以通過傳統療法(包括蛋白酶抑制劑、免疫調節劑和/或抗CD38單抗)獲得緩解,但大多數患者都會經歷反復的疾病進展。在傳統療法下復發的患者,預後較差且治療選擇很少。因此,這些患者存在巨大的未被滿足的臨牀需求,亟需一種有效、安全和方便的治療方法。 澤沃基奧侖賽(Zevor-cel/CT053)是一款靶向B細胞成熟抗原(BCMA)的CAR-T產品,BCMA是一種在血液中的惡性和正常漿細胞表面均表達的蛋白。Zevor-cel構建體利用全人抗BCMA單鏈抗體域,推測可以降低免疫原性並提高安全性。Zevor-cel被認爲可以識別、結合和清除表達BCMA的多發性骨髓瘤細胞。
多發性骨髓瘤(MM)是第二大常見的血液系統惡性腫瘤,骨髓中的漿細胞失去控制的增長,並產生異常蛋白,從而導致包括心髒和腎髒等重要器官受損。根據世界衛生組織的資料,2020年中國有超過21000例MM新病例和近16200例MM死亡病例。盡管患者可以通過傳統療法(包括蛋白酶抑制劑、免疫調節劑和/或抗CD38單抗)獲得緩解,但大多數患者都會經歷反復的疾病進展。在傳統療法下復發的患者,預後較差且治療選擇很少。因此,這些患者存在巨大的未被滿足的臨牀需求,亟需一種有效、安全和方便的治療方法。 澤沃基奧侖賽(Zevor-cel/CT053)是一款靶向B細胞成熟抗原(BCMA)的CAR-T產品,BCMA是一種在血液中的惡性和正常漿細胞表面均表達的蛋白。Zevor-cel構建體利用全人抗BCMA單鏈抗體域,推測可以降低免疫原性並提高安全性。Zevor-cel被認爲可以識別、結合和清除表達BCMA的多發性骨髓瘤細胞。  下載LUMMICAR-2研究結果Zevor-cel於2019年8月獲美國FDA授予孤兒藥稱號,隨後分別於2019年9月及2020年4月獲歐洲藥品管理局(EMA)授予優先藥物(PRIME)資格及孤兒藥稱號。2020年12月,Zevor-cel被NMPA納入突破性治療品種。 此次NDA是基於一項在中國進行的开放標籤、單臂I/II期臨牀試驗(LUMMICAR-1)的數據。該試驗的I期部分共納入14例患者,旨在評估Zevor-cel治療R/R MM患者的有效性和安全性,主要終點爲最大耐受劑量(DLT)和客觀緩解率(ORR)。其結果已在2021年美國血液學會(ASH)年會上公布。 截至2021年7月8日,中位隨訪期爲13.6個月(4.2-22.4個月)。結果顯示,患者的ORR達到100%,其中78.6%(11/14)的患者達到嚴格意義的完全緩解(sCR),並且有64.3%(9/14)的患者實現超過12個月的CR/sCR,92.9%(13/14)的患者達到非常好的部分緩解(VGPR)及以上。達到12個月的無進展生存期(PFS)的患者比例爲85.7% (12/14)。此外,在不伴有髓外病變(EMD)的患者中觀察到了更佳的治療趨勢,CR/sCR率爲91.7% (11/12),12個月的PFS率達到100%。
下載LUMMICAR-2研究結果Zevor-cel於2019年8月獲美國FDA授予孤兒藥稱號,隨後分別於2019年9月及2020年4月獲歐洲藥品管理局(EMA)授予優先藥物(PRIME)資格及孤兒藥稱號。2020年12月,Zevor-cel被NMPA納入突破性治療品種。 此次NDA是基於一項在中國進行的开放標籤、單臂I/II期臨牀試驗(LUMMICAR-1)的數據。該試驗的I期部分共納入14例患者,旨在評估Zevor-cel治療R/R MM患者的有效性和安全性,主要終點爲最大耐受劑量(DLT)和客觀緩解率(ORR)。其結果已在2021年美國血液學會(ASH)年會上公布。 截至2021年7月8日,中位隨訪期爲13.6個月(4.2-22.4個月)。結果顯示,患者的ORR達到100%,其中78.6%(11/14)的患者達到嚴格意義的完全緩解(sCR),並且有64.3%(9/14)的患者實現超過12個月的CR/sCR,92.9%(13/14)的患者達到非常好的部分緩解(VGPR)及以上。達到12個月的無進展生存期(PFS)的患者比例爲85.7% (12/14)。此外,在不伴有髓外病變(EMD)的患者中觀察到了更佳的治療趨勢,CR/sCR率爲91.7% (11/12),12個月的PFS率達到100%。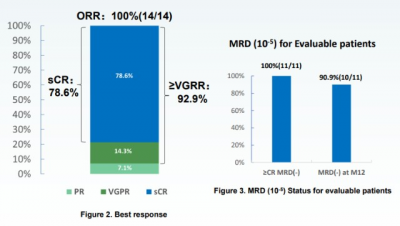
不久前,科濟藥業還在第七屆CAR-TCR年度峰會上公布了一項II期臨牀試驗(LUMMICAR-2)的初步結果。截至2022年9月21日,II期研究中共17例患者入組。結果顯示,在11例(至少隨訪8周)可評估的患者中,客觀緩解率達到100%(VGPR、CR或sCR),並在更長的隨訪期內觀察到緩解加深。此外,所有的MRD陽性患者轉爲陰性。
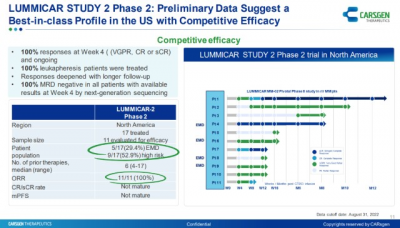 安全性方面,沒有出現死亡,以及沒有患者經歷過3級或者更高的細胞因子釋放綜合徵。在10/17(59%)例患者中觀察到細胞因子釋放綜合徵,均爲1級或者2級。有一例短暫的3級免疫效應細胞相關神經毒性綜合徵被報導且該病人已完全恢復;沒有神經毒性且沒有觀察到具有帕金森特徵。在毒性的處理方面,僅5/17(29%)例患者接受托珠單抗治療,僅1例(5.9%)患者接受糖皮質激素治療。 據醫藥魔方NextPharma數據庫統計,目前全球共8款CAR-T療法獲批上市,其中2款爲靶向BCMA的CAR-T療法,即idecabtagene vicleucel和西達基奧侖賽。
安全性方面,沒有出現死亡,以及沒有患者經歷過3級或者更高的細胞因子釋放綜合徵。在10/17(59%)例患者中觀察到細胞因子釋放綜合徵,均爲1級或者2級。有一例短暫的3級免疫效應細胞相關神經毒性綜合徵被報導且該病人已完全恢復;沒有神經毒性且沒有觀察到具有帕金森特徵。在毒性的處理方面,僅5/17(29%)例患者接受托珠單抗治療,僅1例(5.9%)患者接受糖皮質激素治療。 據醫藥魔方NextPharma數據庫統計,目前全球共8款CAR-T療法獲批上市,其中2款爲靶向BCMA的CAR-T療法,即idecabtagene vicleucel和西達基奧侖賽。 處於上市及申報上市階段的CAR-T療法
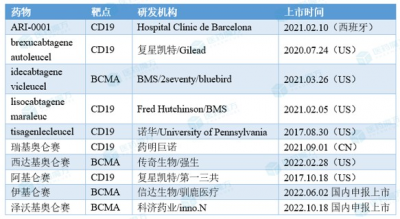 idecabtagene vicleucel由百時美施貴寶和bluebird合作开發,於2021年3月在美國獲批上市,商品名爲Abecma。西達基奧侖賽由傳奇生物和強生合作开發,於2022年2月在美國獲批上市,商品名爲Carvykti。此外,信達生物和馴鹿醫療合作开發的伊基侖賽已於今年6月在國內申報上市。
idecabtagene vicleucel由百時美施貴寶和bluebird合作开發,於2021年3月在美國獲批上市,商品名爲Abecma。西達基奧侖賽由傳奇生物和強生合作开發,於2022年2月在美國獲批上市,商品名爲Carvykti。此外,信達生物和馴鹿醫療合作开發的伊基侖賽已於今年6月在國內申報上市。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:國內第2款!科濟藥業BCMA CAR-T療法「澤沃基奧侖賽」申報上市
地址:https://www.breakthing.com/post/23976.html







