
去年12月22日,前國家食藥監局局長畢井泉在高規格論壇發表演講,主旨是十六個字,“新藥研發九死一生,高風險應有高回報”。
剛好此前一天,基石藥業擇捷美獲批上市,成爲全球首個聯合化療獲批一线治療轉移性鱗狀和非鱗狀非小細胞肺癌患者的PD-L1抗體。
國際學術界對擇捷美的重視非比尋常。1月15日頂級臨牀腫瘤研究期刊《柳葉刀-腫瘤學》(The LancetOncology)發表擇捷美兩個重磅研究結果(GESMTONE-301研究和GEMSTONE-302研究),並於同期發表了一篇評論文章,須知中國臨牀研究能出現在這裏的本就稀少,雙響炮的待遇更是罕見。

(圖一:擇捷美兩項研究重磅發表,來源《柳葉刀-腫瘤學》)
早在去年9月,擇捷美的部分臨牀研究數據就已經分別在世界肺癌大會年會和歐洲腫瘤內科學會年會上被列爲口頭報告向全球發布。
三榜提名,所言非虛。總結如下:
在聯用化療一线治療IV期非小細胞肺癌(NSCLC)患者時,使用擇捷美與使用Keytruda(K藥,全球醫學界推崇的藥王)相比,其總生存期(OS,療效金標准指標)和無進展生存期(PFS,通常的主要臨牀終點指標)獲益程度相當,這一研究結果打破了此前PD-L1抑制劑聯合化療無法取得和PD-1抑制劑一樣療效的僵局;
在鞏固治療放化療後不可切除的III期NSCLC患者時,使用擇捷美與使用Imfinzi(I藥,該領域金標准療法)相比,療效相當。
值得一提的是,The LancetOncology 專家評論文章認爲,擇捷美的非鱗癌研究結果與K藥相比時,中位OS數據“令人驚喜”。換言之,擇捷美與被列爲全球標准的K藥和I藥同時掰手腕也是旗鼓相當,甚至在覆蓋人群廣度上更勝一籌。必須點贊。
回顧擇捷美的故事,創新性和差異化貫穿始終,是擇捷美的靈魂。
01
結構差異化帶來的機制差異化
從埃克替尼到康柏西普,國產創新藥之前的主要开發思路是從美歐原研新藥的分子結構出發做微調,這有顯而易見的好處:藥效機制一致,藥理毒理藥代研究難度低,臨牀方案一致,研發不容易踩雷,速度快且成功率高。缺點是:原研藥的結構是充分研究過的,开發創新藥必須避過專利,結構做了微調後,新分子往往難以達到原研藥的治療效果和臨牀地位。
爲了能脫穎而出,基石藥業設計擇捷美時做了三個層面的不同選擇。
第一層面
擇捷美屬於免疫檢查點抑制劑PD-L1抗體。
腫瘤免疫治療以免疫檢查點阻斷療法爲主,而最被重視的免疫檢查點,非PD-1(受體)/PD-L1(配體)這一對莫屬。由此產生了兩類具有相似療效的抑制劑抗體,PD-1抗體(作用於T細胞,更早誕生,如K藥),和PD-L1抗體(作用於腫瘤細胞,如I藥)。說是相似,還是有不同之處,圖二中右側就是PD-L1抗體的潛在優勢。
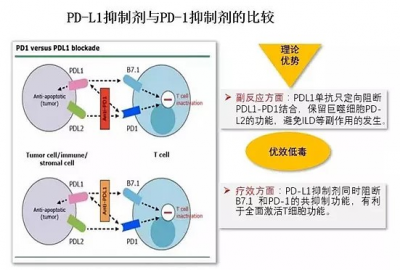
(圖二:PD-L1和PD-1抑制劑的比較,來源網絡)
隨着科學研究的深入,人們發現PD-L1對癌細胞的影響實際遠遠不止PD-1/PD-L1結合的單一作用機制,包括了生長和生存、幹細胞特性、DNA損傷應答和基因調控等多個方面。
PD-L1既能在表達於細胞表面時能夠介導信號傳導,也能在表達於細胞內時調節一系列信號通路。目前推測,細胞質中的PD-L1能夠與mRNA結合並穩定mRNA,導致特定DNA損傷修復蛋白表達水平的上升;細胞核內的PD-L1也許直接與DNA相結合,調控DNA損傷修復和對化療的耐藥性。PD-L1作爲新藥开發的靶點,其潛力仍有待於充分挖掘。
而基於PD-L1顯著的優勢,基石藥業與國內多數創新藥企不同,選擇優先开發PD-L1抗體。
這是开發思路的第一個層面的不同:擇捷美作爲PD-L1抗體,要比PD-1抗體更安全。
第二層面
IgG1和IgG4是人類免疫球蛋白四種結構亞型中的最常用於重組抗體的兩種亞型。通常情況下,PD-1抗體會選擇IgG4亞型,PD-L1抗體會選擇IgG1亞型。詳見圖三。
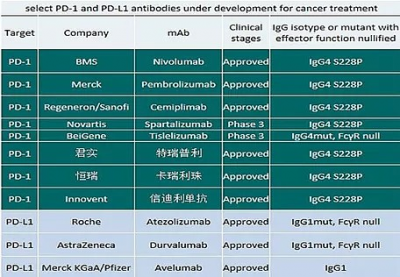
(圖三:通常情況下PD-1和PD-L1抗體的IgG亞型選擇,來源網絡)
這種選擇的原因總體上可以認爲:PD-1抗體與T細胞結合的目的是活化T細胞,如果選擇具有“較強的介導其他細胞攻擊靶細胞的活性”的IgG1亞型,反而可能導致剛剛活化的T細胞耗竭,所以選擇了IgG4;PD-L1抗體與腫瘤細胞結合,可以選用IgG1,但基於對不確定性的擔憂,I藥還是去除了有介導活性的結構部分。
與I藥不同,擇捷美未採用 IgG1 亞型,而是獨創性地採用了先進平台生成的全長全人源化 IgG4 抗體,結構最接近於人體天然的 IgG4 抗體,免疫原性更低,誘導抗藥物抗體(ADA)的幾率較低,因此其導致發熱、輸液反應等不良反應的可能較小,並避免了因 ADA 影響藥物療效。
這是开發思路的第二個不同:擇捷美要比一般的PD-L1抗體更安全。
第三層面
所有PD-(L)1抗體都有阻斷PD-1/PD-L1結合的功能。但擇捷美有雙重機制。
機制1:可以阻斷腫瘤細胞表面的 PD-L1 與 T 細胞表面的PD-1 結合,解除 PD-1/PD-L1 信號通路對 T 細胞的抑制作用,激活特異性免疫,介導 T 細胞殺傷腫瘤;
機制2:激活固有免疫,介導巨噬細胞進一步直接殺傷腫瘤,增強抗原呈遞,刺激免疫系統達到長期療效。
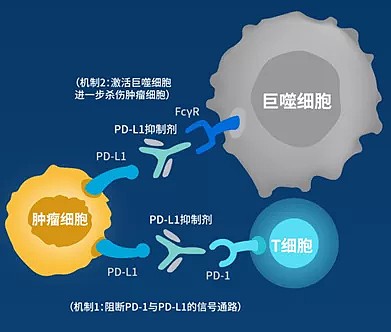
(圖四:擇捷美雙重機制,來源基石藥業)
擇捷美的作用機制2,是其達成比其他PD-L1更高療效的殺手鐗。擇捷美獨特地保留了有介導活性的結構,可以召集巨噬細胞直接殺傷腫瘤。
這是开發思路的第三個層面的不同:擇捷美的雙重作用機制,療效更好。
現在說這三個選擇,語氣輕松。但實際上每步都是險棋,成藥路上,步步驚心。
正是基石藥業研發團隊有最豐富的經驗和高超的預見性,才使得擇捷美走到今天。
現在,擇捷美從III期和IV期NSCLC,到復發難治淋巴瘤,到晚期食管鱗癌,再到晚期胃癌,它已在多個注冊性臨牀中表現出療效和安全性的高度一致性。藥好不好,最終看臨牀。
02
臨牀設計創新性差異化帶來適用患者群體差異化
腫瘤有非常多的細分適應症,每個都有不同規模的患者數量。以肺癌爲例,2020年全球221萬例新發肺癌患者裏,約85%是NSCLC,其他是小細胞肺癌。而NSCLC中有66%的人群一經發現已經是III期(局部晚期)和IV期(轉移性)。對於NSCLC的治療包括手術,放化療,靶向治療和免疫治療等,各種療法又對應着不同的分期分型;療法之間可能有機會結合使用,也可能不適合,比如適合靶向治療的患者如果使用免疫療法,相對驅動基因陰性的患者使用免疫療法,療效會比較差。
既要盡可能減少臨牀試驗中的風險因素,又要多快好省地納入細分適應症人群,更要在與現有上市品種的比較中凸顯自身優勢,臨牀設計何其難也。
爲什么擇捷美的臨牀研究所發表文獻的影響因子(即學術價值)遠遠高於其他諸多國產PD-(L)1抗體?首要原因就是臨牀設計滿足了以上的復合要求。
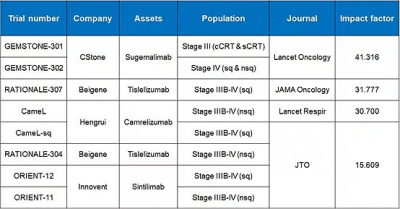
(圖五:多個PD-(L)1抗體注冊性臨牀發表文獻影響因子,來源網絡)
正因爲基石藥業研發團隊與主要研究者有業界一流的臨牀設計能力,擇捷美才創造了多項“全球首個”。
GEMSTONE-302研究—IV期NSCLC
這項研究使擇捷美成爲全球首個獲批聯合化療一线治療轉移性鱗狀和非鱗狀NSCLC患者的PD-L1單抗,和全球首個聯合化療顯著改善鱗狀和非鱗狀IV期初治NSCLC患者OS的PD-L1單抗。
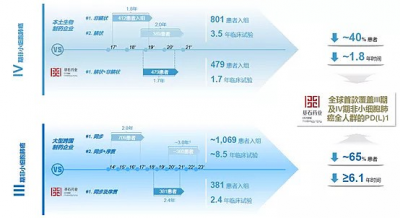
(圖六:GEMSTONE-302和302的差異化設計,來源網絡)
在302研究中,有兩種病理人群(鱗癌,非鱗癌)被納入受試者,一個試驗頂別家兩個,節省了大量時間和費用,減少了受試者進入對照組的數量;同時預設不同細胞組織亞型和PD-L1表達水平的亞組,並最終觀察到均有獲益。
GEMSTONE-301研究—III期NSCLC
基於301研究的上市申請正在審評中,未來獲批後,擇捷美將成爲全球首個可用於同步或序貫放化療後NSCLC患者的PD-(L)1單抗。
在301研究中,創造性地將序貫放化療後患者和同步放化療後患者均納入臨牀研究,並且七成患者屬於IIIB和IIIC等更晚期階段;而主要對標藥物I藥,它的注冊性臨牀研究只納入了同步放化療後患者,並且半數以上屬於IIIA期患者。
在英國,迄今爲止接受同步放化療的患者比例仍不超過50%。而在中國,同步放化療比例僅30%。其他序貫放化療的患者都是用不上I藥的,擇捷美是他們唯一的選擇。這可不是一個小群體,中國每年新增20萬序貫放化療III期NSCLC患者,比很多小瘤種合計還要多。
GEMSTONE-301研究主要研究者、廣東省人民醫院吳一龍教授曾表示,如果說I藥的PACIFIC研究是III期NSCLC治療的一場“海嘯”式變革,那么GEMSTONE-301研究就是“颶風+海嘯”,它爲之前沒有免疫療法可用的序貫放化療後患者群體帶來了新希望。
301與302疊加的質變—全球首個III期和IV期NSCLC全覆蓋
結合301和302研究,擇捷美有望成爲全球首個同時覆蓋III期和IV期NSCLC全人群的 PD-(L)1單抗。這不是因爲對手太慢,而是因爲基石藥業的研發推進實在太快。
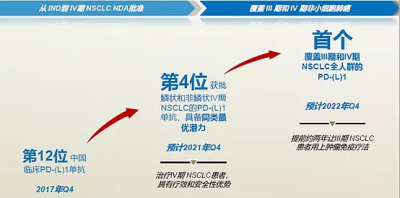
(圖七:擇捷美的臨牀推進速度,來源網絡)
03
臨牀結構優勢凸顯有望重塑肺癌治療格局
中國有12個PD-(L)1抗體上市,其中8個在NSCLC領域有所作爲。
擇捷美在IV期NSCLC領域的臨牀數據可與默沙東的K藥“發起挑战”,因爲K藥是全球醫生公認的首選用藥;III期NSCLC領域的臨牀數據則能與阿斯利康的I藥一較高下,因爲I藥是此方向的金標准療法。
與K藥比
圖八是幾種PD-(L)1抗體聯合化療一线治療IV期NSCLC時,疾病進展或死亡風險降低比例的對比圖,HR of PFS值越低越好。
我們可以清楚地看到,GEMSTONE-302 研究中鱗癌組的HR of PFS達到 0.34,顯著降低疾病進展與死亡風險達 66%,比K藥還要好。如果對鱗癌和非鱗癌患者人群綜合比較,擇捷美降低風險達52%,K藥降低風險是51%,擇捷美和K藥的治療效果可以說是旗鼓相當。
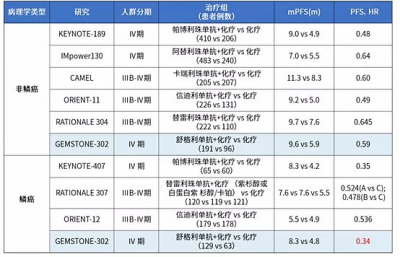
(圖八:HR of PFS對比,來源網絡)
今年1月,基石藥業公布了更新數據,擇捷美的GEMSTONE-302研究達到OS的研究終點,因此成爲全球首個聯合化療顯著改善鱗狀和非鱗狀IV期初治NSCLC患者OS的PD-L1單抗。
GEMSTONE-302研究主要研究者、上海市肺科醫院腫瘤科主任周彩存教授表示,OS數據證明擇捷美有望成爲晚期NSCLC的首選腫瘤免疫治療藥物;擇捷美的研究結果打破了此前PD-L1抑制劑聯合化療無法取得和PD-1抑制劑一樣療效的僵局,爲鱗癌患者填補了PD-L1抑制劑聯合化療一线治療的空白。
K藥的對手來了。
與I藥比
在同步放化療患者的數據比較中,擇捷美中位PFS時間與I藥類似(但“I藥入組患者相對早期,擇捷美入組患者更晚期”),且擇捷美與I藥的18個月PFS率非常接近(43.5%:44.2%),提示這類患者從兩種藥物均能獲益。
但是,I藥當前只獲得了同步放化療後患者用藥的獲益數據,擇捷美卻獲得了同步放化療和序貫放化療後兩種患者用藥的獲益數據。擇捷美先人一步。
與K藥和I藥分別掰了手腕,不敢說擇捷美完勝,至少是打個平手。如果進一步考慮NSCLC患者的廣泛適用性和醫生選擇的便利性,擇捷美會是更優選擇,以一己之力重塑肺癌治療格局。
04
多適應症領域發力
NSCLC是擇捷美臨牀开發的大本營,預期將在2022年Q4覆蓋III期和IV期全部患者人群,對於中國市場,每年大約新發50-60萬人;其中III期序貫放化療患者人群是獨佔市場,每年大約爲20萬人。
肺癌之外,擇捷美已在三個其他適應症領域發力。
2022年1月13日,基石藥業宣布,擇捷美治療復發或難治性結外自然殺傷細胞/T細胞淋巴瘤(R/R ENKTL)的注冊性臨牀研究(GEMSTONE-201)達到主要研究終點,近期提交上市申請。由於目前尚無PD-1或PD-L1抗體被批准用於治療R/R ENKTL,預期擇捷美再創“全球首個”。
2022年1月18日,基石藥業宣布擇捷美兩項重磅三期注冊性臨牀試驗完成全部受試者入組,分別是聯合化療一线治療無法手術切除的局部晚期或轉移性胃/胃食管結合部腺癌的GEMSTONE-303研究(前期數據,疾病控制率達到82.8%),以及聯合化療一线治療無法手術切除的局部晚期,復發或轉移性食管鱗癌的GEMSTONE-304研究(前期數據,疾病控制率達到89.2%)。2020年全球新發胃癌病例超過100萬例,死亡病例達76.9萬例;新發食管癌的病例超過60萬例,死亡病例達54.4萬例,擇捷美有望再收獲兩個大癌種。
05
战略性規劃鋪就全球商業之路
基石藥業不是傳統大型藥企,市場並非其強項。擇捷美已經具備了成爲“爆款”的素質,但也需要高手強強聯合兌現價值。
在中國大陸市場,基石藥業战略合作夥伴輝瑞已經早早拿下擇捷美的獨家商業化權利,畢竟輝瑞的腫瘤藥銷售團隊從規模到業績都值得誇贊。根據相關協議,基石藥業有權獲得最高可達2.8億美元的裏程碑付款及額外的分級特許權使用費。
在海外市場,EQRx公司以1.5億美元的首付款,及最高可達11.5億美元的裏程碑付款以及額外的分級特許權使用費拿下了擇捷美和基石藥業另一款PD-1抗體的商業化權利。目前,EQRx公司已經成功在納斯達克上市,有望進一步加速擇捷美在海外市場的注冊工作,而近期更新的擇捷美研發數據將有力地助力這一進程。
中國創新藥要”走出去”,研究要在世界範圍內發表,注冊要在世界範圍內進行,銷售要在世界範圍內達成,生存與發展一體化。
基石藥業擇捷美這樣的新藥不就是畢井泉在2015年7月22日發起中國新藥研發變革的終極目標嗎?中國企業同樣做得出讓全世界豎起大拇指的好藥。
•END•
- 基石藥業-B(02616)
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:能和K藥I藥掰手腕的基石藥業擇捷美是怎樣煉成的?
地址:https://www.breakthing.com/post/3174.html







