自核心品種耐立克獲批上市以來,亞盛醫藥-B(06855)就一直致力於推動其商業化,得益於耐立克的銷售收入,2022年亞盛醫藥當期營業收入同比大幅上漲了652%。
與此同時,公司也在持續推進耐立克的新適應症擴展研發,近日,耐立克第二次獲CDE納入突破性治療品種,便凸顯了亞盛醫藥在這一發展方向上的階段性成果。
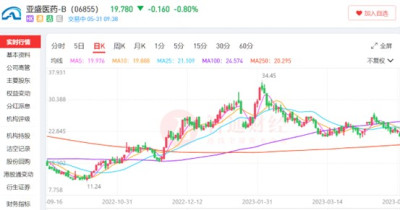
從二級市場角度來看,雖然近期港股生物醫藥板塊處在回調階段,但亞盛醫藥股價依舊保持相對穩定,且公司目前股價較去年10月的最低點已上漲75.98%。
了解到,5月31日,亞盛醫藥宣布,公司原創1類新藥奧雷巴替尼(曾用名耐克替尼;商品名:耐立克)獲國家藥品監督管理局(NMPA)藥品審評中心(CDE)公示,被納入“擬突破性治療品種”公示名單,治療既往經過一线治療的琥珀酸脫氫酶(succinate dehydrogenase, SDH)缺陷型胃腸道間質瘤(GIST)患者。
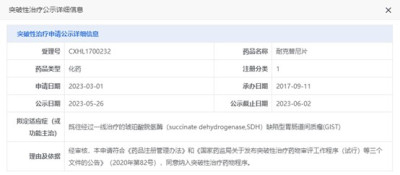
這是耐立克第二次獲CDE納入突破性治療品種。此前於2021年3月,該品種首次獲納入突破性治療品種,用於治療一代和二代酪氨酸激酶抑制劑(TKI)耐藥和/或不耐受的慢性期慢性髓性白血病(CML-CP)患者。
該適應症的上市申請於2022年7月獲NMPA受理並被納入優先審評程序,將支持耐立克獲得完全批准。目前,耐立克已獲得兩項CDE授予的優先審評資格,呈現明顯的臨牀價值與優勢。
突破性治療品種通常被授予用於防治嚴重危及生命或者嚴重影響生存質量的疾病、且尚無有效防治手段或者與現有治療手段相比有足夠證據表明具有明顯臨牀優勢的創新藥或者改良型新藥等。對於被納入突破性治療品種的藥物,CDE將優先配置資源進行溝通交流,加強指導並促進藥物研發進程;申請人經評估符合相關條件的,也可以在申請產品上市許可時提出附條件批准申請和優先審評審批申請。總之,突破性治療品種的審評政策將加快具有重大臨牀價值、臨牀急需的創新藥或者改良型新藥的开發與上市。
GIST是一種起源於胃腸道間葉組織的腫瘤,大部分的GIST患者伴有KIT或PDGFRA基因突變。TKI的出現,改善了這類GIST患者的預後。然而,在SDH缺陷型GIST這一罕見的亞型GIST治療領域,卻存在巨大的、未被滿足的臨牀需求。
雖然近年來隨着KIT和PDGFRA突變基因的發現,以及伊馬替尼、舒尼替尼和瑞戈非尼等的臨牀應用,胃腸間質瘤患者預後已有很大改善。但數據統計仍有5%-10%的GIST病人對上述藥物治療不敏感,這類GIST患者主要存在琥珀酸脫氫酶(SDH)亞基突變,大部分患者仍然會復發。
但目前尚無針對復發和晚期SDH缺陷型GIST患者的標准治療方案,5年無事件生存率(EFS)僅爲24%。
近兩年,國內雖有GIST治療新藥獲批上市,如阿伐替尼、瑞派替尼,但針對的仍然是KIT和PDGFRA突變的病人,而晚期SDH缺陷型GIST仍無有效治療手段。
但如今亞盛醫藥的核心產品耐立克卻展現出了對SDH缺陷型GIST良好的臨牀治療效果。
據了解,耐立克在多個臨牀前GIST模型中呈現了抗腫瘤活性,並得到臨牀數據的初步驗證。值得一提的是,該品種還在SDH缺陷型GIST患者中呈現出令人振奮的抗腫瘤活性。隨着今年的ASCO年會上,奧雷巴替尼治療GIST患者的臨牀數據首次公布,市場也看到了SDH缺陷型GIST治療的新希望。
根據亞盛醫藥披露的最新臨牀數據,一項在中國進行的Ib/II期研究最新數據顯示,耐立克在SDH缺陷型GIST患者中的臨牀獲益率(CBR)高達93.8%
這一出色的臨牀結果以及此次產品獲CDE納入突破性治療品種用於治療SDH缺陷型GIST患者,對於亞盛醫藥後續开發耐立克意義重大。這意味着,若耐立克對SDH缺陷型GIST治療有效,其將填補一項疾病的臨牀用藥空白,也將借此拓展適用範圍至實體瘤領域,有望成爲耐立克今後一個新的銷售增長點。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:亞盛醫藥-B(06855):填補SDH缺陷型GIST治療空白,耐立克再獲BTD迎新增長點
地址:https://www.breakthing.com/post/63349.html







