

近日,國家藥品監督管理局藥品審評中心(CDE)公示了新一批“擬突破性治療品種”,科倫博泰創新TROP2-ADC(SKB264,MK-2870)再度上榜,擬用於既往接受過至少二线系統化療的局部晚期或轉移性激素受體陽性(HR+)和人表皮生長因子受體2陰性(HER2-)的乳腺癌。
 SKB264是一款靶向TROP2的抗體藥物偶聯物(ADC),已分別就局部晚期或轉移性三陰乳腺癌(TNBC)和EGFR-TKI 治療失敗的局部晚期或轉移性EGFR 突變非小細胞肺癌(EGFRm NSCLC)被授予兩項突破性療法認定(BTD)。據醫藥魔方統計,此次公示預示着SKB264有望成爲TROP2-ADC中首個在我國收獲三項BTD的創新產品。科倫博泰作爲國內ADC开發企業的翹楚,近年來收獲頗豐。在項目合作方面,與默沙東達成至多9個ADC項目,前期及裏程碑付款合共高達118億美元的合作,成爲國產創新藥史上的閃亮記錄。在產品开發方面,A166率先提交上市申請,有望成爲國內首款治療HER2陽性乳癌的國產ADC;如今,SKB264有望三度囊獲BTD榮譽,將再一次創造國產TROP2-ADC的榮耀時刻。不禁令人好奇,這樣的成績究竟是產品开發速度奠定的基礎,還是藥物臨牀價值塑造的優勢?
SKB264是一款靶向TROP2的抗體藥物偶聯物(ADC),已分別就局部晚期或轉移性三陰乳腺癌(TNBC)和EGFR-TKI 治療失敗的局部晚期或轉移性EGFR 突變非小細胞肺癌(EGFRm NSCLC)被授予兩項突破性療法認定(BTD)。據醫藥魔方統計,此次公示預示着SKB264有望成爲TROP2-ADC中首個在我國收獲三項BTD的創新產品。科倫博泰作爲國內ADC开發企業的翹楚,近年來收獲頗豐。在項目合作方面,與默沙東達成至多9個ADC項目,前期及裏程碑付款合共高達118億美元的合作,成爲國產創新藥史上的閃亮記錄。在產品开發方面,A166率先提交上市申請,有望成爲國內首款治療HER2陽性乳癌的國產ADC;如今,SKB264有望三度囊獲BTD榮譽,將再一次創造國產TROP2-ADC的榮耀時刻。不禁令人好奇,這樣的成績究竟是產品开發速度奠定的基礎,還是藥物臨牀價值塑造的優勢?
SKB264开發進度全球領先  突破性療法認定是爲了鼓勵研究和創制具有明顯臨牀優勢的藥物而設定的一項藥物審評工作程序,需要藥物在臨牀試驗期間對用於防治嚴重危及生命或者嚴重影響生存質量的疾病且尚無有效防治手段或者與現有治療手段相比有足夠證據表明具有明顯臨牀優勢,才能授予突破性療法認定。 CDE授予SKB264 BTD認定,足以說明對該藥臨牀價值的認可。放眼整個創新藥領域(含進口產品),能夠榮獲三項BTD認定者也是寥寥無幾。
突破性療法認定是爲了鼓勵研究和創制具有明顯臨牀優勢的藥物而設定的一項藥物審評工作程序,需要藥物在臨牀試驗期間對用於防治嚴重危及生命或者嚴重影響生存質量的疾病且尚無有效防治手段或者與現有治療手段相比有足夠證據表明具有明顯臨牀優勢,才能授予突破性療法認定。 CDE授予SKB264 BTD認定,足以說明對該藥臨牀價值的認可。放眼整個創新藥領域(含進口產品),能夠榮獲三項BTD認定者也是寥寥無幾。
同時,對納入突破性治療品種名單的藥物,CDE將優先配置資源進行溝通交流,加強指導並促進藥物研發。經評估符合相關條件的,也可以在申請藥品上市許可時提出附條件批准和優先審評審批申請。從藥物开發周期的角度考慮,獲得BTD之後有望縮短審評審批期間的排隊時間,這無疑有助於加速SKB264的上市進程,更早解決中國患者的未滿足臨牀需求。
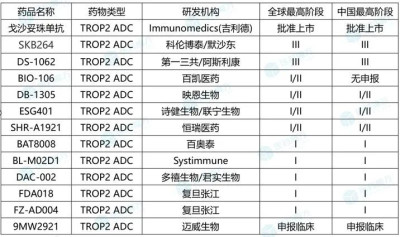
事實上,SKB264的开發進度已經是國產TROP2-ADC中的佼佼者。根據醫藥魔方數據,SKB264是國產TROP2-ADC中當前唯一進入臨牀III期研究的藥物。
TROP2 ADC上市及臨牀在研產品列表(來源:NextPharma)
 更加值得關注的是,SKB264在部分適應症中也做到了全球同步,呈現出齊頭並進的態勢。5月23日,科倫博泰在臨牀試驗公示平台登記了一項評估SKB264單藥對比培美曲塞聯合鉑類治療經表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)治療失敗的EGFR突變的局部晚期或轉移性非鱗NSCLC的隨機、开放性、多中心Ⅲ期臨牀研究(CTR20231535)。這是首項針對EGFR突變 NSCLC开展Ⅲ期臨牀研究的TROP2-ADC,標志着SKB264在EGFR突變NSCLC領域步入全球前列。 此前,SKB264也啓動了一項針對至少接受過2线治療的局部晚期、復發或轉移性三陰性乳腺癌患者的III期試驗(CTR20220878)。除戈沙妥珠單抗之外,這也是國內同類產品在該疾病領域中唯一的一項注冊性研究。同時,SKB264還在中美兩地开展了一項涵蓋乳腺癌、非小細胞肺癌、胃癌、頭頸鱗癌和尿路上皮癌等多種實體瘤的籃子式臨牀試驗(NCT04152499),爲後續全球III期研究鋪平了道路。可以說,無論是從臨牀價值角度還是开發速度考慮,SKB264都有着鮮明的優勢。或許,正是這樣的優勢吸引了默沙東的青睞,爲SKB264的國際化徵程注入強勁助力。
更加值得關注的是,SKB264在部分適應症中也做到了全球同步,呈現出齊頭並進的態勢。5月23日,科倫博泰在臨牀試驗公示平台登記了一項評估SKB264單藥對比培美曲塞聯合鉑類治療經表皮生長因子受體酪氨酸激酶抑制劑(EGFR-TKI)治療失敗的EGFR突變的局部晚期或轉移性非鱗NSCLC的隨機、开放性、多中心Ⅲ期臨牀研究(CTR20231535)。這是首項針對EGFR突變 NSCLC开展Ⅲ期臨牀研究的TROP2-ADC,標志着SKB264在EGFR突變NSCLC領域步入全球前列。 此前,SKB264也啓動了一項針對至少接受過2线治療的局部晚期、復發或轉移性三陰性乳腺癌患者的III期試驗(CTR20220878)。除戈沙妥珠單抗之外,這也是國內同類產品在該疾病領域中唯一的一項注冊性研究。同時,SKB264還在中美兩地开展了一項涵蓋乳腺癌、非小細胞肺癌、胃癌、頭頸鱗癌和尿路上皮癌等多種實體瘤的籃子式臨牀試驗(NCT04152499),爲後續全球III期研究鋪平了道路。可以說,無論是從臨牀價值角度還是开發速度考慮,SKB264都有着鮮明的優勢。或許,正是這樣的優勢吸引了默沙東的青睞,爲SKB264的國際化徵程注入強勁助力。
創新設計奠定臨牀獲益基礎
 出海和國際化是時下國產創新藥的討論焦點。然而,出海東南亞、一帶一路,還是佔據全球絕大多數醫療資源的美歐市場,其玩法卻也有所不同。 我們看到,當面對FDA的“靈魂拷問”時,國產創新藥的結局不盡相同,其核心是研究數據能否經得起臨牀價值的考驗,本質上檢驗的是藥物設計的差異性。SKB264採取了中等毒性載荷高DAR的設計策略,利用專有的Kthiol連接技術和可裂解Linker將靶向TROP2的賽妥珠單抗與拓撲異構酶I(TOPO1)抑制劑KL610023(新型貝洛替康衍生物)偶聯。其中,SKB264中使用的有效載荷和連接子結構都有助於提高ADC的穩定性,從而保證藥物活性。Kthiol 藥物連接技術,可以通過形成不可逆共價結合避免了同類產品中馬來酰亞胺與半胱氨酸可能發生的逆“Michael加成”導致的載荷脫落,改善了ADC穩定性,以及減少脫靶毒性。同時,採用腫瘤專有酶裂解的Linker片段,利用酸性腫瘤微環境選擇性地向腫瘤組織釋放細胞毒性載荷,又避免了在靶脫瘤毒性。
出海和國際化是時下國產創新藥的討論焦點。然而,出海東南亞、一帶一路,還是佔據全球絕大多數醫療資源的美歐市場,其玩法卻也有所不同。 我們看到,當面對FDA的“靈魂拷問”時,國產創新藥的結局不盡相同,其核心是研究數據能否經得起臨牀價值的考驗,本質上檢驗的是藥物設計的差異性。SKB264採取了中等毒性載荷高DAR的設計策略,利用專有的Kthiol連接技術和可裂解Linker將靶向TROP2的賽妥珠單抗與拓撲異構酶I(TOPO1)抑制劑KL610023(新型貝洛替康衍生物)偶聯。其中,SKB264中使用的有效載荷和連接子結構都有助於提高ADC的穩定性,從而保證藥物活性。Kthiol 藥物連接技術,可以通過形成不可逆共價結合避免了同類產品中馬來酰亞胺與半胱氨酸可能發生的逆“Michael加成”導致的載荷脫落,改善了ADC穩定性,以及減少脫靶毒性。同時,採用腫瘤專有酶裂解的Linker片段,利用酸性腫瘤微環境選擇性地向腫瘤組織釋放細胞毒性載荷,又避免了在靶脫瘤毒性。 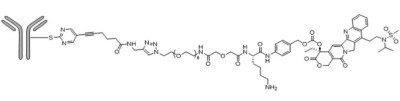

相同給藥劑量,但在腫瘤中更高的毒性載荷暴露,這樣的趨勢或表明SKB264可能具有更高的抗腫瘤效力和安全性潛力。在不同的CDX模型中,SKB264相較於戈沙妥珠單抗,可以達到更高的腫瘤生長抑制(TGI)和消退。
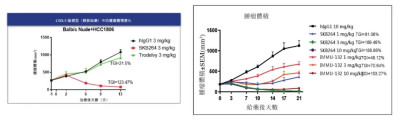
來源:科倫博泰招股書
這種趨勢在臨牀研究中也开始逐步顯現。近期,美國臨牀腫瘤學會(ASCO)年會上公布了SKB264用於EGFR突變NSCLC患者末线治療的研究數據。結果顯示[2],在39名可進行療效評估的患者中,SKB264的ORR達到43.6%,DCR爲94.9%,中位DoR爲9.3個月。對於EGFR野生型亞組(先前接受包括抗PD-(L)1治療在內的中位2线治療),ORR爲26.3%,DCR爲89.5%,中位PFS爲5.3個月。在TKI耐藥的EGFR突變NSCLC亞組(一线化療失敗患者佔50%)中,ORR爲60.0%,DCR爲100%,中位PFS爲11.1個月。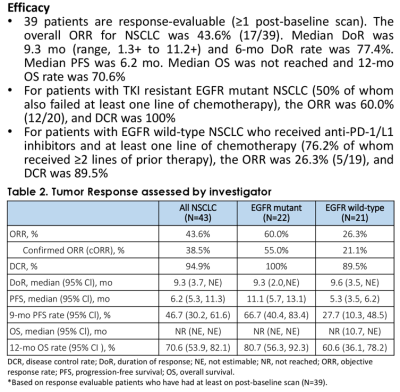
來源:2023 ASCO
可以說,相對於目前同類已上市或處於臨牀後期的產品,SKB264在EGFR突變NSCLC中具有更好的數據表現。同樣,在TNBC末线患者中,SKB264相對於戈沙妥珠單抗和DS-1062,展示了更高的ORR數據(非頭對頭研究),分別爲43.6%、35%和32%。其中,SKB264在TROP2高表達的患者中,確認的ORR(cORR)更是達到55.2%[1]。 在HR+/HER2-乳腺癌中,根據科倫博泰招股書披露的截至2022年11月15日的數據[1],可進行療效評估的28名患者確定的ORR爲42.9%(12/28),DCR爲85.7%(24/28),相對於同類產品也是有着更好的潛力。
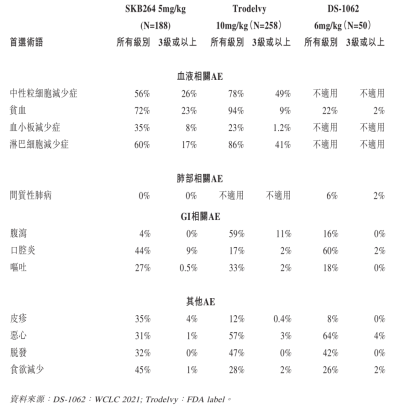
來源:MSD ASCO Investor Event
差異化的創新藥設計理念,必須接受臨牀實踐的驗證,而SKB264也需要在III期臨牀研究中爲自身贏得認可。不過,就SKB264目前表現的臨牀價值,疊加开發速度優勢和BTD的政策支持,無疑爲該藥在市場競爭中帶來先天優勢。臨牀價值塑造商業潛力

肺癌和乳腺癌在國內乃至全球範圍內仍然是最爲常見的惡性腫瘤。
根據國際癌症研究機構(IARC)數據[3],乳腺癌和肺癌是全球最高發的兩類惡性腫瘤,2022年發病人數分別爲226萬和221萬;其中,肺癌導致180萬例死亡,是全球死亡人數最多的惡性腫瘤。在中國[4],肺癌也是發病人數和死亡人數均排第一的惡性腫瘤,2020年發病人數和死亡人數分別爲81萬和71萬;2020年,國內乳腺癌發病人數超41萬,是女性患者中發病人數最高的惡性腫瘤,嚴重威脅着民衆健康。龐大的患者群體也就決定了抗腫瘤藥的市場規模。近年來,ADC藥物作爲明星賽道,其市場規模也在逐年增大,已由2017年的16億美元增長至2022年的72億美元,並預計以31.2%的復合年增長率持續快速增長。同樣,中國的ADC市場也會隨着藥物獲批數量的增多而逐年提高,預計將以復合年增長率79.4%的速度在2030年達到689億元,其中TROP2 ADC藥物將佔據236億元的市場規模[1]。TROP2作爲在多種癌症(如BC(TNBC及HR+/HER2- BC)、NSCLC、GC及OC)中普遍過度表達的腫瘤特異性抗原,具有廣泛的適應症基礎。當然,對於每一種具體的抗腫瘤藥物而言,其臨牀價值也將在一定程度上決定其市場潛力。HR+/HER2–乳腺癌是最常見的乳腺癌亞組,約佔全部乳腺癌病例的70%[5]。此次,SKB264獲得HR+/HER2-乳腺癌的BTD認定,加之此前在TNBC(約佔乳腺癌15%)適應症上的BTD認定,標志着SKB264有望在乳腺癌領域獲得更廣泛的應用空間。內分泌治療是美國及中國晚期HR+/HER2-乳腺癌的主要治療方法。然而,據估計,40%-50%的晚期HR+/HER2-BC患者對內分泌治療有耐藥性。內分泌治療難治的患者目前可用的有效治療選擇有限,對有效的基於非內分泌療法的治療存在巨大的臨牀需求。而TROP2在HR+/HER2-BC中過度表達,令靶向TROP2的ADC藥物成爲潛在的治療手段。戈沙妥珠單抗是當前美國唯一獲批用於治療晚期HR+/HER2-乳腺癌的TROP2-ADC,目前已成爲年銷售額超6億美元的創新產品,並預計將在2028年達到28億美元。毫無疑問,戈沙妥珠單抗的成功爲TROP2-ADC的开發樹立了典範與榜樣。而SKB264作爲首個在TNBC、EGFR突變NSCLC等領域率先开啓多項III期臨牀开發的國產TROP2 ADC,則有望挑起國產TROP2 ADC大旗,未來將展現怎樣的商業價值也是令人充滿期待。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:科倫博泰SKB264(MK-2870)擬被授予第3項突破性療法認定,TROP2-ADC再迎榮耀時刻
地址:https://www.breakthing.com/post/71437.html







