
3月30日,中國國家藥監局藥品審評中心(CDE)官網公示,德國默克(Merck KGaA) 的鹽酸特泊替尼上市申請獲受理。
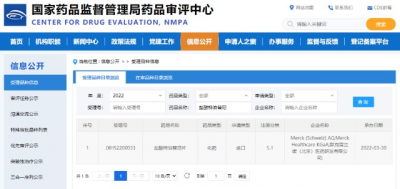
圖1. 鹽酸特泊替尼上市申請獲受理,來源:CDE官網
特泊替尼(tepotinib,商品名Tepmetko)是一款口服c-MET抑制劑,已在日本和美國獲批上市,用於治療攜帶MET外顯子14(MET ex14)跳躍的非小細胞肺癌(NSCLC)患者。
1、c-MET與癌症
間質表皮轉化因子 (c-Mesenchymal-epithelial transition factor, c-Met)是受體酪氨酸激酶的一種,其編碼合成的蛋白c-Met是可以與肝細胞生長因子(HGF)結合的一種受體酪氨酸激酶。
c-MET通路正常表達時促進組織的分化與修復,當調節異常時則促進腫瘤細胞的增殖與轉移。MET通路異常激活在許多實體瘤中發生,包括腦癌、乳腺癌、結直腸癌、胃癌、頭頸癌、肺癌、肝癌、皮膚癌、前列腺癌和軟組織癌等,這種異常激活可通過非HGF依賴性機制發生,主要包括MET 14號外顯子跳躍突變、MET擴增、重排和MET蛋白過表達。
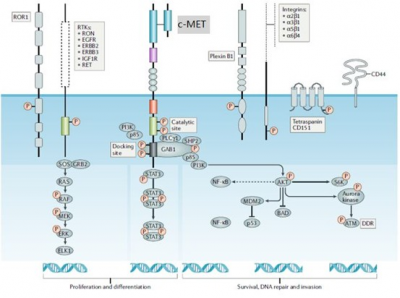
圖1. c-Met相關信號通路示意(參考2)
c-MET已成爲當下癌症領域的熱門研究靶點之一。目前小分子c-Met抑制劑又分爲單靶點或多靶點的c-Met抑制劑。
單靶點c-Met抑制劑 能夠錨定Met較爲獨特的鉸鏈區域,高選擇性抑制Met激酶;
而多靶點c-Met抑制劑能夠靶向多個激酶,它們的VEGFR活性遠高於Met活性,用於靶向Met致癌突變較爲勉強,例如Crizotinib(克唑替尼)等。
因此下面我們主要了解單靶點c-Met抑制劑。
2、c-Met抑制劑代表藥物
全球首款獲批的c-Met抑制劑——特泊替尼
特泊替尼是全球首款獲批的c-Met抑制劑,最早於2020年3月25日獲得日本厚生勞動省批准,並在日本上市。2020年8月26日,FDA授予特泊替尼優先審查資格,用於治療MET ex14突變的轉移性NSCLC患者。在此前,特泊替尼曾被FDA授予突破性療法稱號,並獲日本厚生勞動省授予的創新藥物資格與孤兒藥稱號,可以說是備受贊譽。
圖2. 特泊替尼知識圖譜,來源:藥渡數據
特泊替尼在日本和美國獲批的關鍵性臨牀試驗是一項名爲VISION的單臂、多中心、开放標籤臨牀II期研究。總計152名攜帶MET ex14突變的晚期或轉移性NSCLC患者接受了特泊替尼單藥治療。他們不攜帶EGFR或ALK基因突變。
結果顯示,特泊替尼在初治和經治患者中均達到43%的總緩解率。初治和經治患者的中位緩解持續時間(DOR)分別爲10.8個月(95% CI,6.9-NE)和11.1個月(95% CI,9.5-18.5)。67%的初治患者和75%的經治患者的緩解持續時間爲6個月以上,30%的初治患者和50%的經治患者的緩解持續時間爲9個月以上。
首款獲FDA批准的c-Met抑制劑——卡馬替尼
卡馬替尼(Capmatinib,商品名Tabrecta)是首款獲FDA批准的c-Met抑制劑。 由諾華公司(Novartis)研發, 2020年5月6日,FDA批准卡馬替尼上市,用於治療MET ex14突變的NSCLC患者。
圖3. 卡馬替尼知識圖譜,來源:藥渡數據
此次批准基於卡馬替尼的Ⅱ期GEOMETRY mono-1試驗,該試驗是一項多中心、非隨機、多隊列的Ⅱ期臨牀試驗,入組了97例帶有MET ex14突變的晚期或轉移性NSCLC患者。主要評價指標爲客觀緩解率(ORR)及DOR。
研究結果顯示,在28例初治患者中,ORR爲68%(其中4%爲完全緩解,64%爲部分緩解),DOR爲 12.6個月;在69例經治患者中,ORR爲41%(41%爲部分緩解),DOR爲 9.7個月。
國內首款獲批的c-Met抑制劑——賽沃替尼
賽沃替尼(Savolitinib,商品名Volitinib)由和黃醫藥研發,於2021年6月22日獲NMPA批准上市,用於治療MET ex14突變的局部晚期或轉移性NSCLC患者。這是國內首個申報上市的c-Met抑制劑,也是賽沃替尼的全球首個新藥上市申請。
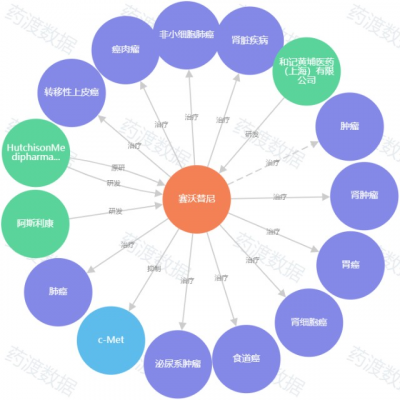
圖4. 賽沃替尼知識圖譜,來源:藥渡數據
它的獲批是基於一項开放、II期研究,該研究納入中國32個中心的70名MET ex14突變NSCLC患者,中位隨訪17.6個月,結果顯示:在療效可評估的61名患者中,ORR爲49.2%,疾病控制率(DCR)爲93.4%,產生應答的中位時間爲1.4個月,DOR爲8.3個月。另外,和黃醫藥也在开發賽沃替尼的胃癌和結直腸癌適應證,均到了II期階段。
3、國內小分子c-Met抑制劑研發現狀
海和藥物——谷美替尼
谷美替尼是由上海海和藥物與中國科學院上海藥物所合作研發的小分子c-Met抑制劑。臨牀前研究顯示谷美替尼強效和特異性靶向抑制MET激酶活性。初步臨牀研究結果顯示,谷美替尼具有優良的藥代動力學特性以及良好的安全性和耐受性,在人體中藥物半衰期長,穩態谷濃度高,有利於靶點的持續抑制。谷美替尼在MET ex14突變的NSCLC中顯示了初步療效。
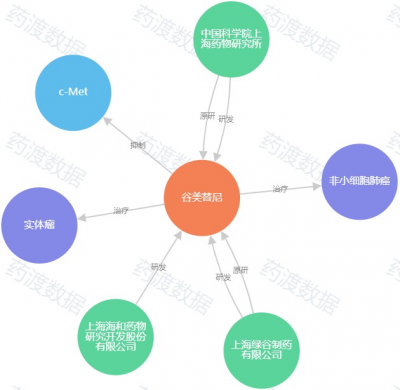
圖5. 谷美替尼知識圖譜,來源:藥渡數據
2021年9月,谷美替尼被CDE納入突破性治療品種;2022年1月,谷美替尼也獲得美國FDA授予的孤兒藥資格,用於治療具有MET基因變異的NSCLC患者。
浦潤奧生物——伯瑞替尼
伯瑞替尼由北京浦潤奧生物科技公司自主研發。2020年,伯瑞替尼治療c-Met異常的晚期NSCLC的I期臨牀試驗結果亮相AACR年會。
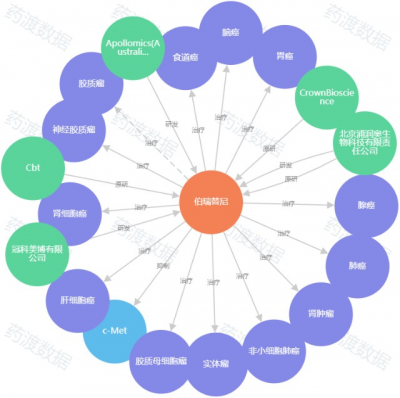
圖6. 伯瑞替尼知識圖譜,來源:藥渡數據
該研究在37名經治但未接受c-Met抑制劑或HGF靶向治療的,局部晚期或轉移性晚期NSCLC患者中展开,結果顯示:在所有36名可評估療效的患者中,伯瑞替尼的ORR爲30.6%,DCR爲94.4%。亞組分析中,在攜帶c-Met過表達、擴增或ex14跳躍突變的患者中,ORR分別爲30.6%、41.2%和66.7%。
目前,伯瑞替尼被CDE擬納入突破性治療品種,治療MET ex14突變的NSCLC患者。此外,該藥還擬被开發用於治療神經膠質瘤、腎細胞癌(RCC)和肝細胞癌(HCC)。
此外國內還有江蘇豪森的HS-10241正在开展臨牀試驗,適應證爲MET ex14突變的NSCLC,另外肝癌和胃癌適應證也在臨牀研究中。
4、小分子c-Met抑制劑市場前景
在非小細胞肺癌中,3%-5%的患者會出現MET基因擴增或外顯子14發生突變,這類患者預後較差,而且對傳統化療和免疫治療均不敏感。我國每年新發的肺癌超過80萬例,其中非小細胞肺癌約佔80%-85%,在這一龐大的患者基數下,3%-5%的突變頻率同樣對應爲數不少的患者,這些患者亟需低毒高效的靶向新藥上市。
另外在接受EGFR-TKI治療發生耐藥性的患者中,大約有50%是T790M突變的,另有約20%的患者爲c-Met擴增。對於這部分患者來說,c-Met抑制劑成了一劑良藥。
目前國內布局小分子c-Met抑制劑的公司大部分處於研發早期,而且由於MET基因變異與多種癌症相關,有利於在適應證上進行差異化布局,避免同質化競爭。
總之,國內留給c-Met抑制劑的市場是充足的。不過,由於c-Met成爲了研究人員开發癌症(尤其是非小細胞肺癌)靶向藥物的熱門靶點之一,除了單靶點抑制劑外,還有針對c-Met的多靶點抑制劑、雙抗和抗體偶聯藥物(ADC)等,國內就有十余款c-Met靶向藥物邁入臨牀階段,因此要想搶佔市場先機,只有唯快不破。
參考資料:
1.CDE官網
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:默克c-Met抑制劑在華申報上市,江蘇豪森、海和藥物多企布局,後來者還有機會嗎?
地址:https://www.breakthing.com/post/7629.html







