
2022年,BTK抑制劑澤布替尼全球銷售額達38.29億元,約佔$百濟神州(HK|06160)$產品總銷售收入的45%(84.80億元),是毫無疑問的當家產品。澤布替尼所處的血液腫瘤也是百濟神州的重點布局領域之一。目前,公司管线中有3款自研產品進入臨牀階段,除了澤布替尼,還有Bcl-2抑制劑sonrotoclax(BGB-11417),以及BTK-CDAK產品BGB-16673。
不同的靶點方向有不同的發展路徑,有各自主攻的適應症方向,也有協同作業。在近日舉辦的百濟神州血液腫瘤高峰論壇上,我們從管线最新進展和开發策略的解讀,進一步了解百濟神州血液腫瘤管线在形成怎樣的矩陣。
澤布替尼
性淋巴細胞白血病(CLL)/小淋巴細胞淋巴瘤(SLL)這一適應症可以說是澤布替尼开發中非常重要的裏程碑。
2020年,澤布替尼獲中國食藥監總局(NMPA )批准治療復發或難治性CLL/SLL;去年10月,頭對頭ALPINE試驗公布結果,證實澤布替尼優於伊布替尼;今年1月,獲FDA批准用於復發或難治性CLL/SLL。
CLL/SLL本身有較大的市場需求,也是BTK抑制劑最大的細分市場,進入這個市場明顯帶動澤布替尼的銷售。據公司發布的第一季度財報,澤布替尼在美國第一季度銷售額總計9.50億元,上年同期美國市場銷售額總計4.31億元,120%的增長主要來自CLL/SLL適應症上的推動。
實際上針對CLL/SLL適應症,澤布替尼趁熱打鐵,有一系列布局和新的動向,主要體現在從復發難治向一线新診斷的進軍。今年5月,NMPA批准澤布替尼四項注冊申請,包括兩項新增適應症的上市許可申請,其中之一是新診斷的成人CLL/SLL,一項是新診斷成人華氏巨球蛋白血症(WM)。還有兩項附條件批准轉爲常規批准的補充申請,包括既往至少接受過一種治療的成人CLL/SLL和WM。
聯合治療也是一個發展重點。據百濟神州副總裁、中國血液腫瘤臨牀开發負責人郭海宜介紹,B細胞瘤裏面,公司以已經證實了同類最優的BTK抑制劑澤布替尼作爲一個基石,圍繞它可以進行很多不同的聯合探索,不同的作用機制進行聯合,1+1大於2的方向。
在這些聯合的探索中,進展較快的包括聯合奧妥珠單抗用於治療既往至少經過二线治療後復發或難治性濾泡性淋巴瘤(FL)成人患者,今年7月,該聯合方案在美國遞交了上市許可申請(sNDA),是在美國的第5項新適應症;另有與sonrotoclax聯合治療新發的CLL/SLL的全球3期多中心臨牀即將啓動,BTK與Bcl-2產品聯合是被業界認爲比較有潛力的方向,該機理聯合方面已有獲批方案,2022年Venetoclax聯合伊布替尼一线治療CLL被歐盟批准。
最優到首創的拓展
對於百濟神州而言,Bcl-2抑制劑sonrotoclax代表的則是另一個“盤子”。
郭海宜表示,公司現階段針對血液腫瘤有兩盤不同適應症的大布局,其中之一是以Bcl-2抑制劑爲核心的研發領域,圍繞此,還有TIM3、CD70和LAC-3相關產品,適應症主要在白血病、骨質增生異常綜合症、多發性骨髓瘤等方向。
百濟神州針對sonrotoclax的开發策略與澤布替尼類似,尋求的是“同類最佳”潛力。
Bcl-2抑制劑領域,第一個獲批也是目前唯一獲批的產品是Venetoclax,這必然是sonrotoclax重要的參照系。據郭海宜介紹,公司通過對sonrotoclax進行結構調整,使它具有更好的效能,sonrotoclax對野生型的效價是Venetoclax的大約14倍,對於可能產生耐藥的Bcl-2突變患者效價是Venetoclax的57倍,同時sonrotoclax有很高的選擇性。
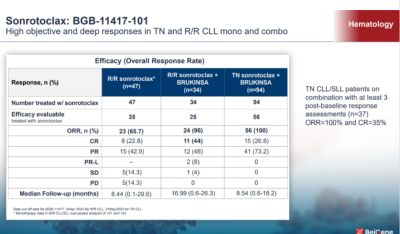
sonrotoclax的臨牀研究數據已經陸續公布出來。最近舉辦的百濟神州研發日上,較新的數據顯示,sonrotoclax聯用澤布替尼在初治的CLL/SLL中,客觀緩解率(ORR)達到了100%,在至少3次基线評估的患者中 (n=37) ,完全緩解率(CR)達到了35%。
郭海宜表示,更值得欣喜的是,BTK抑制劑無論是共價還是非共價的,因爲作用機制的問題,不太能達到微小病竈的全部清除,Bcl-2抑制劑這方面有更好的表現,而sonrotoclax相比於第一代的Venetoclax,微小殘留病竈清除更高,Venetoclax達到微小病竈殘余清除的中位時間爲13~18個月,sonrotoclax的中位時間在6~7個月。目前看來,相比於單藥,sonrotoclax在與澤布替尼聯合中有更好的表現。
在公司血液腫瘤管线中,另一款核心產品BGB-16673的开發策略與上述的澤布替尼和sonrotoclax有所不同。
BGB-16673是一款蛋白降解產品(PROTAC),是百濟神州CDAC平台的第一款產品。針對BTK靶點的PROTAC產品,主要解決的是BTK抑制劑的耐藥問題,目前還沒有上市的。2022年1月,BGB-16673獲NMPA批准進入臨牀,是國內第二款,全球第三款進入臨牀的BTK-PROTAC。因此,BGB-16673的开發策略追求的是同類首創。
於處在更爲早期階段的BGB-16673,郭海宜進一步介紹,BGB-16673在最低爬坡劑量時,已經可以看到BTK蛋白降到了不可測量的水平,而且可以相當長時間去維持。這意味着其未來在臨牀上有很大的潛力達到很好的治療效果。目前這個項目在中國和全球非常快地推進中。
由於同樣作用於BTK靶點,現場有人提問,是否會开展BGB-16673與澤布替尼的頭對頭研究。郭海宜回應:目前不會开展與澤布替尼頭對頭研究,針對BGB-16673的开發主要還是解決現在臨牀上暫時未解決的問題,比如澤布替尼效果很好,但是長期治療的還是會出現疾病進展、復發,主要的適應症CLL/SLL現在爲止還是不可治愈的疾病,BGB-16673會在這塊做一定的探索。
<END>
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:澤布替尼之後,百濟神州血液腫瘤管线還有哪些儲備
地址:https://www.breakthing.com/post/86770.html







