【產業洞察】從利拉魯肽、度拉糖肽到司美格魯肽:鐵打的GLP-1營盤,流水的“藥王”
艾塞那肽是第一款獲FDA批准上市的短效GLP-1RA,一日給藥兩次。然而,由於它的半衰期太短,氨基酸序列與人類GLP-1的差異大,可能導致人體的免疫系統產生特異性抗體,所以並沒有佔領太多市場。
利拉魯肽是由諾和諾德研發的每日一次注射給藥的人源性GLP-1受體激動劑,於2010年被FDA批准上市。直到2018年,利拉魯肽一直是GLP-1RA領域的王者,2019年利拉魯肽已經快佔到全球市場銷售額的40%,而短效藥艾塞那肽和利司那肽的份額已經少到可以忽略不計。
利拉魯肽的銷冠位置被度拉糖肽終結,度拉糖肽是由禮來研發的長效制劑,一周給藥一次,於2014年被FDA批准上市,2019年度拉糖肽被NMPA批准上市後,銷售額急劇上升,在2020年銷售額超過利拉魯肽登上冠軍寶座。
然而好景不長,度拉糖肽的銷冠還沒坐多久就被司美格魯肽終結,司美格魯肽在頭對頭試驗中打敗了度拉糖肽和利拉魯肽,得益於肥胖症的獲批2022年司美格魯肽各種形式銷售額總和突破百億美元,成爲GLP-1類藥王。近期諾和諾德發布半年報,三款司美格魯肽產品上半年共計銷售92.2億美元,全年有望突破200億美元,增長速度驚人。
不過,禮來首款獲批的GLP-1/GIP受體雙重激動劑替爾泊肽實力非凡,在頭對頭試驗中打敗了司美格魯肽,近期禮來公布的財報裏顯示替爾泊肽第二季度銷售額高達9.8億美元,上半年銷售額高達15.48億美元,放量可謂迅速,未來有望成爲下一任GLP-1類藥王。
相關文章回顧:
全球首個GLP-1R/GIPR/GCGR三靶點激動劑來襲,GLP-1 3.0版本時代开啓!
豪擲19億美元!禮來「減肥」賽道成長啓示錄
01 獲批上市的GLP-1類藥物
胰高血糖素樣肽1(GLP-1)是一種30或31個氨基酸長的肽激素,主要由腸道L細胞分泌。其受體GLP-1R在胰腺中主要表達在胰島細胞中,此外還廣泛表達在胃、小腸、心髒、腎髒、肺及大腦等組織。
一开始發現GLP-1在2型糖尿病中具有許多潛在的有益作用,如降低胰高血糖素濃度、提高胰島素敏感性、減慢胃排空速率、增加飽腹感和降低遊離脂肪酸濃度等(圖1)。然而,天然GLP-1的治療效果受到其非常短半衰期和快速降解的限制。
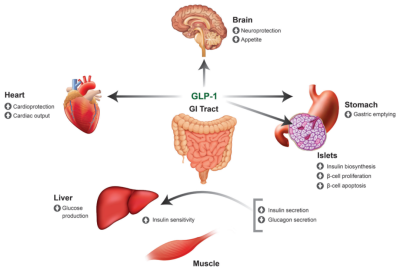
圖1. GLP-1在人體中的作用
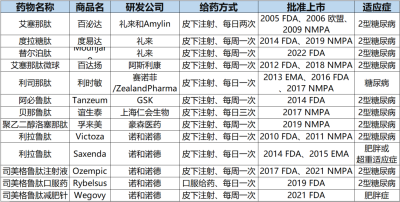
爲了改善GLP-1的成藥性質,後續人們通過不同手段开發新型的GLP-1類似物即GLP-1RA,目前有十幾種GLP-1RA獲批上市,在國內就有8種GLP-1RA獲批上市,包括短效/速效制劑貝那魯肽、艾塞那肽和利司那肽以及長效制劑利拉魯肽、艾塞那肽微球、度拉糖肽和司美格魯肽注射液(圖2)。
表1. 獲批上市的GLP-1RA
02 第一代藥王:利拉魯肽
利拉魯肽是諾和諾德研發的一種人GLP-1的類似物,通過在肽前體位置26處的賴氨酸殘基上連接帶有谷氨酸間隔物的C-16脂肪酸(棕櫚酸)和位置34處用精氨酸代替賴氨酸改造而得,與人GLP-1同源性達到97%,可作爲GLP-1受體激動劑(圖2)。
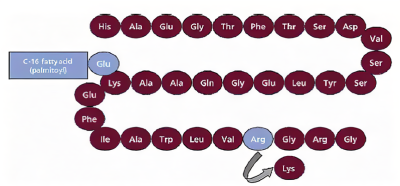
圖2. 利拉魯肽的結構(深紅色是人類GLP-1蛋白原有的氨基酸),來源:rxlist網站
利拉魯肽半衰期爲13小時,26處賴氨酸殘基上連接的脂肪酸側鏈,可以使利拉魯肽抵抗二肽基肽酶4(DPP-4)酶降解、與白蛋白緊密結合,體內半衰期顯著延長,還可以使利拉魯肽分子在注射部位自交聯成七聚體,從而延緩其釋放,使其作用時間可長達接近24小時,每天皮下注射一次並且可在任意時間注射,與進餐無關。
利拉魯肽於2009年7月首先在歐盟上市,2010年在美國上市,用於治療2型糖尿病,在美國商品名爲Victoza;2011年進入中國市場,商品名爲諾和力。
目前只有兩款GLP-1類藥物獲批肥胖症適應症,包括利拉魯肽注射液(3.0 mg)和司美格魯肽注射液(2.4 mg),利拉魯肽(3.0 mg)是全球第一個被美國FDA(2014年)和歐洲EMA(2015年)批准用於減重的GLP-1RA,商品名Saxenda,主要適用於身體質量指數(BMI,又稱體重指數)≥ 30 kg/m2的患者,或是BMI ≥ 27 kg/m2同時伴有並發症的患者。
利拉魯肽由於是人源性GLP-1類似物,且給藥周期比艾塞那肽長,上市後銷售額穩步上升。2017年8月,利拉魯肽進入國家醫保目錄,奠定了其在中國的市場基礎,直到2018年,利拉魯肽一直是GLP-1RA領域的王者,但是從2019年开始利拉魯肽降糖藥Victoza銷售額开始下降,主要是受到度拉糖肽和司美格魯肽的衝擊影響。
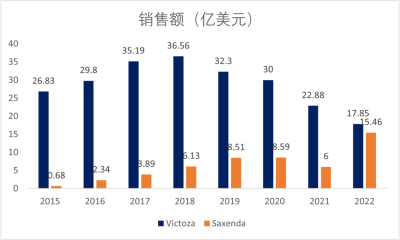
圖3. 利拉魯肽降糖藥Victoza和減肥針Saxenda的銷售額對比
03 第二代藥王:度拉糖肽
度拉糖肽是由禮來研發的將GLP-1多肽與抗體Fc片段融合形成的,於2014年首次在美國上市,是一款長效GLP-1受體激動劑,每周給藥一次(圖4)。2019年2月,度拉糖肽在中國獲批上市,商品名爲度易達,適用於成人2型糖尿病患者的血糖控制,包括單藥以及接受二甲雙胍和/或磺脲類藥物治療血糖仍控制不佳的患者。
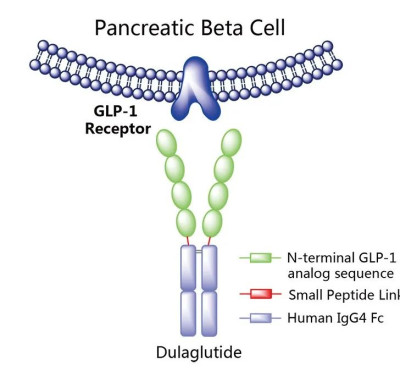
圖4. 度拉糖肽作用示意圖,來源:藥渡數據
度拉糖肽於2020年2月還被FDA批准用於治療心血管疾病或存在多種心血管風險因素的2型糖尿病成人患者,降低主要不良心血管事件(MACE)發生風險。
2023年1月,禮來在國內申報了度拉糖肽聯合胰島素治療成人2型糖尿病的新適應症,基於度拉糖肽聯合胰島素治療的3期AWARD-CHN3研究,達到主要終點和所有關鍵次要終點。
度拉糖肽自2014年獲得FDA批准以來,市場份額擴張迅速,2018年銷售額約32億美元,已經接近GLP-1王牌產品利拉魯肽。2019年,度拉糖肽全球銷售額達到41.3億美元,爲全球GLP-1銷售冠軍,佔其市場份額39%,並位列全球藥品銷售額TOP100榜第19位,2022年銷售額達到74.4億美元,但是銷售額還是被司美格魯肽超越了(圖5)。
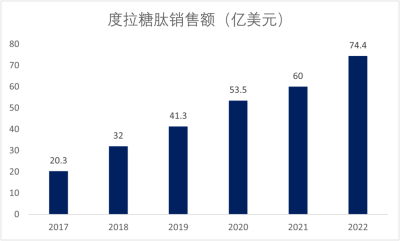
圖5. 2017-2022年度拉糖肽銷售額數據
04 第三代藥王:司美格魯肽
司美格魯肽以天然人GLP-1分子爲基礎,把第8位丙氨酸替換成-氨基丁酸和第34位賴氨酸替換成精氨酸,同時在第26位賴氨酸通過間隔基連接C18脂肪二酸側鏈。經過改造,司美格魯肽實現了可抵抗DPP-4降解、與白蛋白緊密結合、體內半衰期顯著延長,實現每周給藥1次,同時保留了高達94%的GLP-1氨基酸序列同源性結構特徵,具有較好的安全性(圖6)。
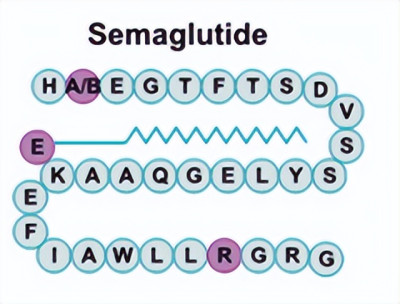
圖6. 司美格魯肽的結構
司美格魯肽是諾和諾德繼利拉魯肽後上市的第二款GLP-1R激動劑,也是繼利拉魯肽後全球第二款獲得肥胖和2型糖尿病(T2DM)雙適應症的GLP-1R激動劑。
司美格魯肽有注射液和口服制劑兩種劑型,司美格魯肽注射液分別於2017年和2021年被FDA(商品名Ozempic)和NMPA(商品名諾和泰)批准用於治療2型糖尿病;司美格魯肽口服藥(商品名Rybelsus)於2019年9月獲得FDA批准,用於2型糖尿病患者的血糖控制,成爲全球首個獲批的口服GLP-1藥物。2021年,司美格魯肽注射液Wegovy被FDA批准用於成人肥胖症。
在一項司美格魯肽和度拉糖肽的頭對頭臨牀試驗(SUSTAIN7)研究結果中顯示,在低劑量和高劑量下,司美格魯肽在改善血糖控制和減輕體重方面,使更多的2型糖尿病患者能夠達到有意義的血糖目標和體重減輕臨牀目標,具有相似的安全性(圖7)。
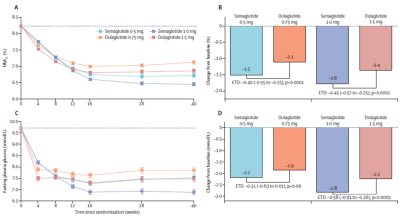
圖7. 司美格魯肽和度拉糖肽的頭對頭臨牀試驗結果
司美格魯肽現在是諾和諾德的明星產品,它的減肥針Wegovy更是被世界首富馬斯克在推特上推薦過,曾一度賣脫銷,供不應求。在減肥領域,諾和諾德推出過利拉魯肽注射液(Saxenda)和司美格魯肽注射液(Wegovy)兩款產品,在一項頭對頭試驗中,司美格魯肽的減肥效果顯著優於利拉魯肽。在平均基线體重爲104.5 kg的肥胖患者中,經過68周治療後,司美格魯肽患者的平均體重下降17.1%,顯著優於利拉魯肽組患者體重下降6.6%的幅度。
司美格魯肽自上市以來,銷售額急劇上升,去年注射型、口服型降糖藥以及減肥針三種劑型司美格魯肽銷售額首次突破百億美元。近期,諾和諾德發布半年報:
Ozempic銷售額爲417.41億丹麥克朗(61.9億美元),同比增長58%;口服制劑Rybelsus銷售額爲83.44億丹麥克朗(12.4億美元),同比增長97%;Wegovy的銷售額爲120.81億丹麥克朗(18億美元),同比增長超過367%(圖8)。
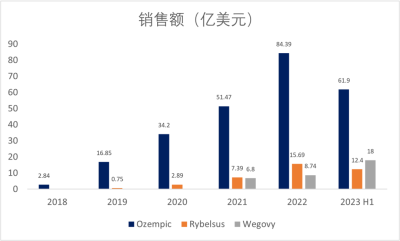
圖8. 司美格魯肽的銷售額
05 下一代藥王:替爾泊肽
替爾泊肽(tirzepatide,Mounjaro)是由禮來研發的首款獲批的GIP/GLP-1受體雙重激動劑,是一個39個氨基酸長的多肽分子,經過對天然的GIP上20位的賴氨酸中,增加了一個20碳的脂肪酸和替換2和13位上的精氨酸爲2-氨基異丁酸(Aib)修飾而得,阻礙DPP-4降解以及能更好地和白蛋白結合延長半衰期,其半衰期大致爲5天(圖9)。
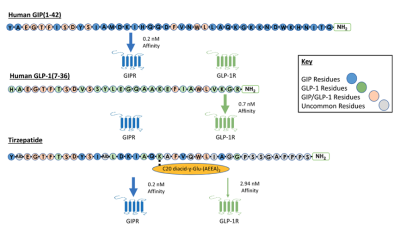
圖9. GIP、GLP-1和替爾泊肽結構
替爾泊肽於2022年5月被FDA批准用於改善2型糖尿病(T2D)成人患者的血糖控制,它是一種長效制劑,每周皮下注射給藥一次。並且替爾泊肽於2022年10月19日被FDA授予用於治療伴有體重相關共病的肥胖或超重成人患者快速通道資格(FTD)。
在替爾泊肽與司美格魯肽的頭對頭試驗中(NCT03987919),替爾泊肽表現出了比司美格魯肽更爲優秀的降糖和減重能力。
試驗結果顯示分別使用5mg、10mg和15mg替爾泊肽糖化血紅蛋白水平與基线的估計平均變化爲−2.01%、−2.24%和−2.30%,司美格魯肽則爲-1.86%。5 mg、10 mg和15 mg替爾泊肽組,體重減輕幅度大於1mg司美格魯肽組,分別爲:0.15%,0.39 %和0.45%(圖10)。
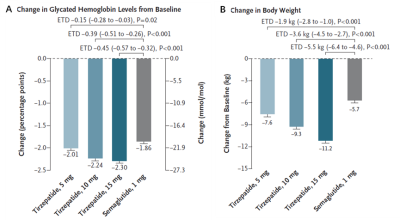
圖10. NCT03987919試驗結果
7月27日,禮來公布了替爾泊肽的SURMOUNT-3和SURMOUNT-4兩項試驗結果。在SURMOUNT-3研究中,參與者經過12周的強化生活方式幹預,使用替爾泊肽實現了21.1%的平均體重減輕,從研究進入开始在84周內總共平均體重減輕了26.6%。SURMOUNT-4研究中,參與者在36周的替爾泊肽導入期內體重減輕了21.1%,在52周的持續治療期間體重減輕了6.7%,在88周內總平均體重減輕了26.0%。
替爾泊肽在獲批上市不到半年裏,銷售額已超2億美元,2022年銷售額達到4.83億美元。近期禮來發布2023年第二季度財報顯示,替爾泊肽銷售額大漲,上半年銷售額達到15.48億美元,放量迅速有望成爲下一代GLP-1類藥王。
06 小結
GLP-1類藥物因其優秀的降糖減重效果而被廣泛關注,從2005年的艾塞那肽至今已接近20年時間裏,GLP-1類藥物在糖尿病和肥胖症中的應用越來越多,佔比越來越高。“藥王”也經歷了好幾代,從利拉魯肽到度拉糖肽再到司美格魯肽,雖然替爾泊肽在一項頭對頭試驗中打敗了司美格魯肽,但是它想取代司美格魯肽還有很長一段路要走。司美格魯肽不僅有注射型降糖藥,也有口服型降糖藥,不過口服型降糖藥是每日一次給藥。替爾泊肽是注射給藥,目前只獲批了糖尿病這一適應症,司美格魯肽還在研發口服減肥藥,相對於減肥針來說,口服減肥藥更爲患者接受。
GLP-1“藥王”的桂冠一直是在禮來和諾和諾德之間競爭,下一次易主不知道是否又會易到禮來家?歡迎持續關注!
作者:士研咨詢
附:
6天5板开开實業:公司“大健康”轉型相關業務的發展都需要較長的培育期
海科新源:東營工廠擁有醫藥級和食品級丙二醇(藥王用輔料)資質 目前滿負荷生產
“藥王”司美格魯肽的專利布局
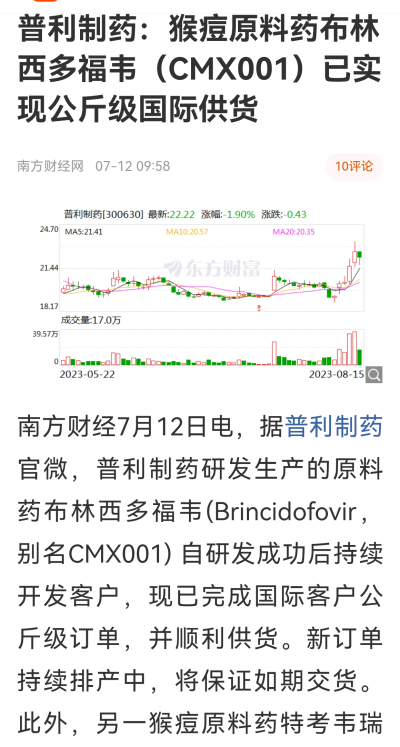
@普利制藥(SZ300630)
(一)化合物專利
FDA橙皮書中的US8129343與US8536122同爲司美魯肽的基礎化合物專利,其中國同族專利CN200680006674.6已授權,有效期截至2026年3月19日。中國化合物專利在其授權公告文本的權利要求1就保護了司美魯肽的結構。
在此之前,司美格魯肽原料藥出路只有三個:(1)原研,(2)仿制藥企研發制劑時的一批放大批,三批驗證批,三次臨牀批。這筆錢5000萬起步吧。(3)非規範市場。即無視美國專利的國家。這個量特別大。仿制藥大約500多億美金。
(二)組合物/制劑專利
根據FDA公布的產品說明書,司美魯肽注射液中含有丙二醇作爲其輔料之一。FDA橙皮書中的US8114833保護了含有丙二醇的肽制劑,其中國同族專利CN200480034152.8已授權,有效期截至2024年11月17日。
中國的司美格魯肽仿制藥針劑的國內申請與注冊,全部都是這個專利。奇怪的是資本市場沒人去炒丙二醇概念股。我已經說過諾和諾德的商業壁壘:釀酒酵母菌生產的。國內要么是化學合成的,要么是大腸杆菌生產的。你愿意买化學合成的或大腸杆菌生產的,沒人攔着。你愿意买他們的股票,更沒人攔着。即使原研,也有明顯的副作用。當副作用出現時你會不疑心,我不信。
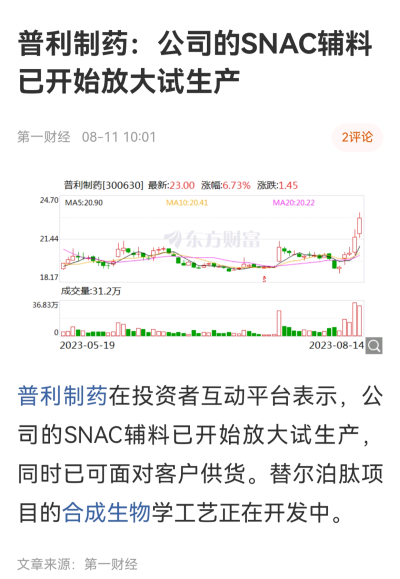
(三)口服制劑專利
諾和諾德公司於2011年12月16日要求的中國專利CN201180060463.1於其公开文本的權利要求1要求保護“包含GLP-1激動劑和N-(8-(2-羥基苯甲酰)氨基)辛酸鹽(SNAC)的用於口服給藥的固體組合物”,並於權利要求11將所述的GLP-1激動劑限定爲司美魯肽。但由於C Beglinger等人在Pharmacokinetics and Pharmacodynamic Effects of Oral GLP‐1 and PYY3‐36: A Proof‐of‐concept Study in Healthy Subjects.(Clinical Pharmacology and Therapeutics, 2008, 84(4):468~474) 一文中已經公布了採用SNAC實現GLP-1受體激動劑口服給藥的技術方案,而且技術問題以及技術效果均與CN201180060463.1相同,因此,審員以最終以不滿足創造性要求爲理由駁回了該專利申請。
(4)諾和諾德又申請了一系列外圍專利,進行補救。
例如,2013年3月15日申請的CN2013800115554.2已獲得授權,該專利對包含司美魯肽與SNAC的口服藥物組合物進行了改良,公告文本的權利要求1保護的技術方案如下所示:包含第一類型顆粒和第二類型顆粒的藥物組合物,其中所述第一類型顆粒包含SNAC且不含GLP‑1肽,且其中所述第二類型顆粒包含GLP‑1肽且不含SNAC,所述SNAC的釋放與所述GLP‑1肽的釋放同時發生,或者所述SNAC的釋放比所述GLP‑1肽的釋放更快,所述釋放是通過使用基於美國藥典35的測定(I)的溶出度試驗在30分鐘內、pH值1‑6.8的任一pH下進行確定的。
還有幾個外圍專利。這些專利2033年到期。這些外圍專利是可以挑战的。但是,你起碼要做一款口服司美格魯肽出來吧。你到諾和諾德去买1克SNAC出來做研發,它會賣給你嗎?
不是吹牛,你到普利去买,也不會隨便买1克給你。肯定要司美格魯肽與SNAC打包賣給你,沒有5000萬人民幣進账,真的沒有瞟一眼的時間。你認爲是見錢眼开,我樂意。你認爲是強盜法則,我幸福。
順便說一句,這種生產兩類顆粒物並且合成藥片的,國內只有一條生產线,在杭州普利,從意大利進口的。目前因爲美國對華進行技術封鎖,中國已經很難進口了。
背後的鬥爭會非常復雜。你希望普利半年內就落地,就像希望普利半年內市值達到1000億。如果那么確定,這股票天天漲停,也輪不到你买進。
作者:股友f976w72199
附:
輝瑞注射劑工廠受災,國產注射劑有望加速出海
事件:7 月 19 日,美國北卡羅來納州出現改良型藤田級數第二級龍卷風,
輝瑞位於美國北卡羅來納州落基山的一個主要生產工廠嚴重受損。
輝瑞落基山工廠是全球最大的無菌注射劑基地之一,本次基地受損將加劇美
國藥品供應短缺。輝瑞位於北卡羅來納州落基山的工廠擁有超過 140 萬平方英
尺的生產空間,是世界上最大的無菌注射劑設施之一,年產能達 4 億多支,美國
醫院使用的所有無菌注射劑中有 25%是該工廠所生產。落基山工廠是輝瑞在
2015 年收購 Hospira 所整合獲得,Hospira 是世界領先的注射藥物和輸注技術
供應商,主要生產麻醉劑、鎮痛劑、治療劑、抗感染藥和神經肌肉阻滯劑等多種
藥物,包括安瓿、小瓶、注射器等小容量產品和靜脈輸液袋、半硬質瓶等大容量
產品。本次輝瑞工廠事件將導致美國注射劑藥品短缺加劇,我們看好國產注射劑
產品加速出海,在美國注射劑市場的份額有望進一步提升。
普利制藥注射劑出海進入收獲期,國際化注冊能力和經驗豐富。公司在制劑
技術研發和全球化注冊方面具有豐富的技術儲備和經驗,截至 2022 年已取得產
品批准文號 239 個,其中歐美等境外制劑生產批件有 108 個;目前有 25 款在歐
洲、美洲、亞洲多國上市的藥品,其中有 20 款注射劑;已在美國獲得 ANDA 的
產品有 20 款,均爲注射劑。公司與輝瑞落基山工廠(Hospira)有 9 款產品重
疊,其中包括阿奇黴素、比伐盧定、鹽酸多巴酚丁胺、碘帕醇、左乙拉西坦、鹽
酸萬古黴素、達托黴素等大品種。建設 GMP 級注射劑工廠通常需要 2-3 年,短
期內美國藥物供應短缺的情況難以緩解,公司注射劑產品的海外銷售有望進一步
提升,境外收入或將持續增長。
形成中國制造、全球銷售格局,持續建設符合國際標准的生產產能。公司已
形成海口、杭州、安慶三處高端藥物制劑及原料藥制造基地的建設,劑型覆蓋針
劑、片劑、膠囊、幹混懸劑、滴眼劑和軟膏等,三地形成關鍵中間體、原料藥和
制劑一體化布局。目前公司原料藥、凍幹粉針劑生產线已通過美國 FDA、歐盟
EMA 及 WHO 相關生產質量規範(cGMP、GMP)審計,小容量注射液生產线
和口服固體制劑生產线已通過美國 FDA、歐盟 EMA 的 cGMP、GMP 審計,GMP
級產能釋放助力公司長期業績增長。
投資建議:我們預計 2023-2025 年公司歸母淨利潤分別爲 4.84/5.68/6.69
億元,對應 PE 分別爲 19/16/14 倍,首次覆蓋,給予“謹慎推薦”評級。
風險提示:市場競爭加劇風險;海外業務拓展不及預期風險;資產減值風險


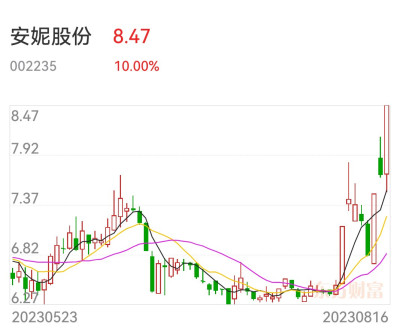
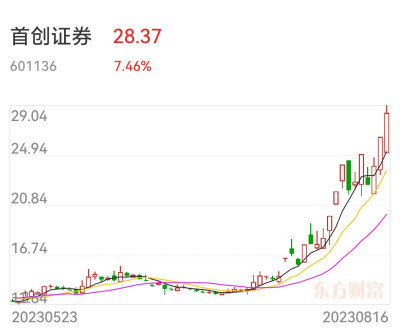
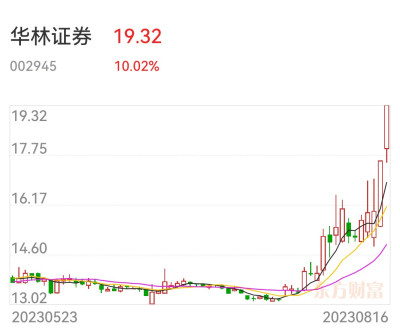
A股最近在大炒“新股次新股”,行業爲券商和醫藥,如首創證券、華林證券都是次新券商股,
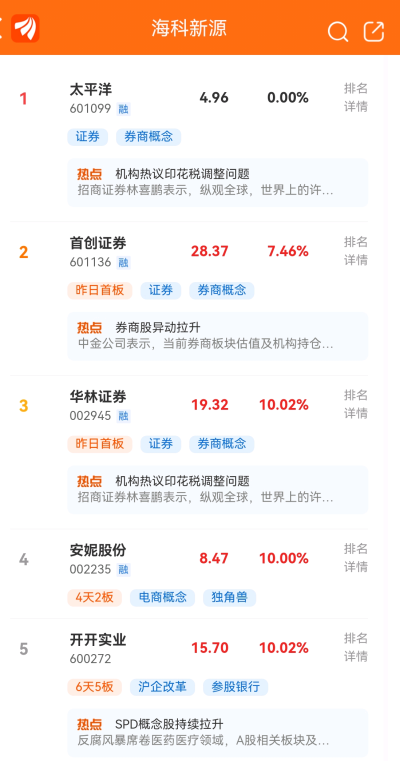
开开實業是醫藥股,只有安妮股份是電商概念股。
*聲明:本文僅是介紹醫藥疾病領域研究進展或簡述研究概況或分享醫藥相關訊息,並非也不會進行治療或診斷方案推薦,也不對相關投資構成任何建議。
本菜鳥所有帖子(包括但不限於文字、視頻、音頻、數據及圖表)僅代表個人觀點,不對您構成任何投資建議,據此操作風險自擔。$首創證券(SH601136)$ $華林證券(SZ002945)$ $安妮股份(SZ002235)$
$禮來(NYSE|LLY)$$諾和諾德(NYSE|NVO)$$普利制藥(SZ300630)$
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:“新一代千億藥王”現身 “开开”6天5漲停 次新券商股醫藥股反復拉高
地址:https://www.breakthing.com/post/89516.html







