
引言
2022年7月19日,阿斯利康發布聲明宣布,其與第一三共合作的HER2靶向ADC藥物Enhertu(DS-8201)在歐盟獲得批准,作爲單一療法,用於接受一種或多種先前基於抗HER2的方案治療的HER2陽性轉移性乳腺癌患者。此次批准將Enhertu在歐洲的適應症擴大到早期用於HER2陽性轉移性乳腺癌。
在獲得歐盟批准後,阿斯利康將向第一三共支付7500萬美元,作爲HER2陽性轉移性乳腺癌二线治療的裏程碑付款。該裏程碑將作爲阿斯利康2019年向第一三共支付的預付款及後續資本化裏程碑的補充資本化,並將通過損益表攤銷。
關於Enhertu
Enhertu藥物基本信息
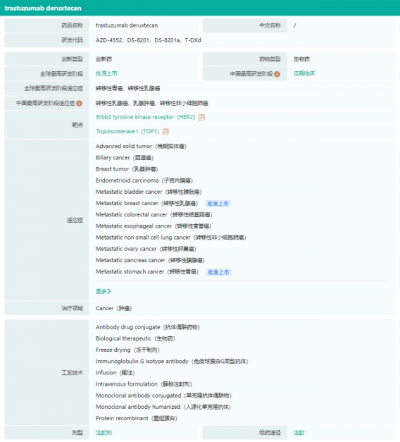
截圖來源:藥融雲全球藥物研發數據庫
據藥融雲數據庫顯示,Enhertu是阿斯利康與第一三共合作研發的HER2靶向的ADC藥物。該藥物有多項適應症處於研發中,比如轉移性乳腺癌、轉移性胃癌、轉移性巢癌、轉移性食管癌、轉移性非小細胞肺癌等,目前前2項適應症已獲批上市。Enhertu最早於美國2019年12月上市,獲批適應症爲轉移性乳腺癌。2021年1月,轉移性胃癌適應症又獲美國FDA獲批。
Enhertu適應症研發現狀

截圖來源:藥融雲全球藥物研發數據庫
獲批基於
歐盟委員會(EC)的批准遵循人用醫藥產品委員會的積極意見,並基於DESTINY-Breast03 III期試驗的結果,該試驗發表在《新英格蘭醫學雜志》上。在試驗中,與曲妥珠單抗(T-DM1)相比,Enhertu將患者(HER2陽性不可切除和/或轉移性乳腺癌,之前接受過曲妥珠單抗和紫杉烷治療)的疾病進展或死亡風險降低了72%(風險比[HR]0.28;95%置信區間[CI]0.22-0.37;p<0.000001)。

DESTINY-Breast03 III期試驗的其他結果表明,在總生存期(OS)的次要終點中,Enhertu存在改善OS的強烈趨勢(HR0.55;95%CI0.36-0.86),但該分析並非如此尚未成熟,進一步的後續行動正在進行中。幾乎所有接受Enhertu治療的患者(96.1%)在9個月時存活,而接受T-DM1治療的患者爲91.3%。Enhertu組與T-DM1組相比,確認的客觀緩解率(ORR)增加了一倍以上(79.7%對34.2%)。
基於DESTINY-Breast03的結果,歐洲醫學腫瘤學會臨牀實踐指南於2021年10月更新,建議將Enhertu作爲紫杉烷和紫杉烷進展後HER2陽性轉移性乳腺癌患者的首選二线治療。
作爲此次批准的一部分,歐盟還將Enhertu在這種情況下的市場保護期延長了一年,因爲與現有批准的療法相比具有顯著的臨牀益處。
國內上市情況
今年3月21日,第一三共向CDE提交了Enhertu的NDA申請,僅一月之隔,4月24日,Enhertu(trastuzumab deruxtecan)就被納入優先審評。相信Enhertu的國內獲批也不會太遠。

小結
目前市場上的ADC藥物多數是基於HER2靶點开發,結構上參考了羅氏的T-DM1。基於強大的HER2陽性及低表達患者治療效果,Enhertu的上市,給ADC市場帶來了鮎魚效應,迫使藥企不斷提高研發技術,推出效果更好的ADC藥物。
參考來源:
[1] CDE官網
[2] 藥融雲數據庫
[3] 阿斯利康官網
[4] Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer
<END>
- 阿斯利康(US ADR)(AZN)
- 阿斯利康(UK)(AZN)
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:阿斯利康:ADC藥物Enhertu歐盟獲批!早期用於乳腺癌her2陽性
地址:https://www.breakthing.com/post/9405.html







