
2022年9月5日,康寧傑瑞公布其自主研發的PD-L1/CTLA-4雙抗KN046和HER2雙抗KN026四項臨牀研究的最新數據,並將在9月9-13日舉行的ESMO 2022年會上以壁報形式亮相。
KN046是康寧傑瑞自主研發的全球性首創PD-L1/CTLA-4雙特異性抗體,同時靶向具有明顯結構差異的PD-L1及CTLA-4,可改變腫瘤微環境的定位及減少脫靶毒性。
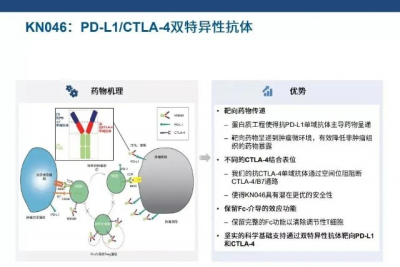 (來源:康寧傑瑞官網)
(來源:康寧傑瑞官網)
KN046在中國、美國和澳大利亞已开展覆蓋NSCLC、三陰乳腺癌、食管鱗狀細胞癌、肝細胞癌、胰腺導管腺癌、胸腺癌等10余種腫瘤的近20項不同階段臨牀試驗。這些研究的初步結果表示示KN046在治療中具有良好安全性和顯著療效。
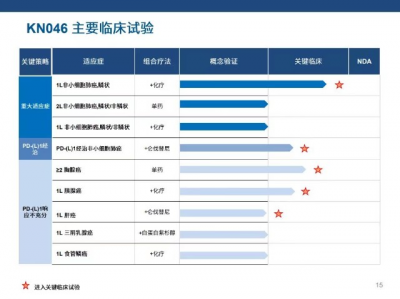
(來源:康寧傑瑞官網)
KN026是康寧傑瑞採用具有自主知識產權Fc異二聚體平台技術(CRIB)开發的HER2雙特異性抗體,可同時結合 HER2的兩個非重疊表位,導致HER2信號阻斷,優於曲妥珠單抗或者帕妥珠單抗單用,達到曲妥珠單抗和帕妥珠單抗聯用的效果,如展示出更高的親和力,在HER2陽性腫瘤細胞株中具備優效的腫瘤抑制作用。同時,KN026對 HER2中低表達腫瘤和曲妥珠單抗抗性細胞株也有抑制作用。
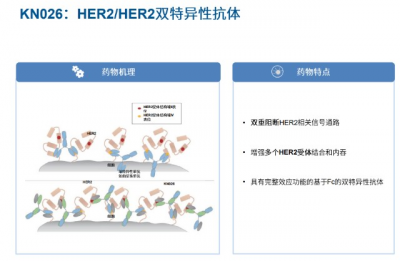
(來源:康寧傑瑞官網)
KN026已於2018年分別獲得中國國家藥品監督管理局(NMPA)和美國食品藥品監督管理局(FDA)的批准,目前正在中國开展多項Ⅰ/Ⅱ期臨牀試驗,同時在美國推進Ⅰ期臨牀試驗。Ⅰ期臨牀試驗結果表明,KN026具有良好的耐受性和安全性,在多线抗HER2治療後進展的HER2陽性乳腺癌患者中仍然表現出顯著的抗腫瘤活性。

(來源:康寧傑瑞官網)
以下爲KN046和KN026四項臨牀研究的最新數據:
一.KN026聯合KN046用於治療既往未接受系統性治療的HER2陽性局部晚期不可切除或轉移性胃癌/胃食管交界部癌(GC/GEJ)的一項II期臨牀研究 研究目的:該研究爲一項开放,多中心的II期臨牀試驗,旨在評估KN026聯合KN046用於治療HER2陽性實體瘤的療效及安全性。研究方案:該研究入組的患者接受30mg/kg Q3W的KN026(第一個周期的第1天和第8天負荷劑量)聯合5mg/kg Q3W的KN046,直至出現疾病進展或毒性不耐受。
主要研究終點:客觀緩解率(ORR)和中位反應持續時間(DoR)。 研究結果
療效:27名可評估患者中,ORR爲77.8%(95% CI:57.7至91.4),DCR爲 92.6%(95% CI:75.7至99.1)。 安全性:常見的治療相關不良事件(TRAE)包括腹瀉(32.3%)、發熱(32.3%)、白細胞減少(22.6%)、中性粒細胞減少(16.1%)及輸液相關反應(16.1%),大多數爲1級或2級。僅5名患者(16.1%)經歷3級或以上TRAE,最常見的爲腹瀉(6.5%)。概無因治療相關的死亡。 結論:KN026聯合KN046治療既往未接受系統性治療的HER2陽性局部晚期不可切除或轉移性胃癌/胃食管交界部癌(GC/GEJ)表現出卓越的療效和可控的安全性。 二.KN046聯合含鉑雙藥化療一线治療NSCLC的兩年隨訪 研究目的:該研究爲一項开放式標籤、多中心的II期臨牀試驗,旨在評估KN046聯合含鉑雙藥化療治療晚期NSCLC患者的療效、安全性及耐受性。研究方案:確診的晚期NSCLC患者入組後被分配到兩個隊列。隊列1:非鱗狀NSCLC患者接受KN046 (5mg/kg Q3W)聯合化療(500mg/m2 Q3W的培美曲塞和AUC=5 Q3W的卡鉑);隊列2:鱗狀NSCLC患者接受KN046 (5mg/kg Q3W)聯合化療(175mg/m2 Q3W的紫杉醇和AUC=5 Q3W的卡鉑)。 主要研究終點:ORR和DoR;次要研究終點包括PFS、OS、安全性及耐受性。 研究結果:截至2022年3月15日
療效:在所有入組患者中,確認的ORR爲46%(95% CI:35.2至57.0),中位PFS及中位OS分別爲5.8個月(95% CI:5.26至7.10)和26.6個月(95% CI:16.92至NR)。 安全性:在所有入組患者中,發生率爲20%或以上的3級或以上治療期間不良事件包括中性粒細胞減少(35.6%,31名患者)及白細胞減少(25.3%,22名患者);發生率爲20%或以上的irAE包括瘙癢(28.7%,25名患者)、AST升高(24.1%,21名患者)和皮疹(20.7%,18名患者)。 結論:KN046聯合含鉑雙藥化療作爲NSCLC一线治療展示出良好的耐受性和頗具前景的臨牀效果。兩個隊列的中位OS均超過2年,療效令人鼓舞。預計將在正在進行的III期臨牀試驗中獲得更大人群的療效和安全性數據。三.KN046(PD-L1/CTLA-4雙特異性抗體)用於一线含鉑雙藥化療治療失敗的轉移性NSCLC患者的II期研究 研究目的:該研究爲一項开放性、多中心、多隊列的單臂II期臨牀試驗,旨在評估KN046用於治療NSCLC的療效、安全性及耐受性。 研究方案:該臨牀試驗入組一线含鉑雙藥化療治療失敗且未接受PD-(L)1免疫檢查點抑制劑治療的患者,但未入組EGFR突變及或ALK重排的患者。入組患者被分配到兩個隊列(隊列A及隊列B)。隊列A患者接受靜脈注射3mg/kg Q2W的KN046,而隊列B患者接受靜脈注射5mg/kg Q2W的KN046。 主要研究終點:根據RECIST v1.1評估的ORR。 研究結果:截至2020年4月30日,64名一线治療失敗的轉移性NSCLC患者入組。截至數據截止日期(即2021年8月31日),中位隨訪時間爲21.6個月(95% CI:20.3至23.2)。 療效:在64名患者中,ORR爲14.1%(9/64,95% CI:6.64至25.02),中位PFS爲3.7個月(95% CI:2.9至5.5),中位OS爲18.4個月(95% CI:12.9至21.9)。在41名非鱗狀NSCLC患者中,ORR爲17.1%(7/41,95% CI:7.15至32.06),中位PFS爲3.7個月(95% CI:2.76至5.45),中位OS爲19.8個月(95% CI:13.04至23.36);而在20名鱗狀NSCLC患者中,ORR爲10.0%(2/20,95% CI:1.23至31.70),中位PFS爲7.4個月(95% CI:1.81至14.39),中位OS爲12.9個月(95% CI:8.97至NR)。 安全性:該臨牀試驗的所有64名入組患者中,27名患者(42.2%)經歷過3級或以上TRAE。最常見的3級或以上TRAE包括輸液反應(10.9%,7名患者)、肝功能障礙(4.7%,3名患者)及肺炎(3.1%,2名患者)。 結論:KN046在治療一线含鉑雙藥化療治療失敗的晚期NSCLC患者中展示出良好的耐受性和療效,並在鱗狀和非鱗狀NSCLC中展示出頗具前景的OS效益。四.KN046(PD-L1/CTLA-4雙特異性抗體)用於既往EGFR-TKIs治療失敗的轉移性NSCLC患者的II期研究 研究目的:一項开放性、多中心、多隊列的單臂II期臨牀試驗,旨在評估KN046用於治療轉移性NSCLC的療效、安全性及耐受性。 研究方案:該臨牀試驗入組既往EGFR-TKIs治療失敗且未接受含鉑化療治療的EGFR敏感性突變的患者。入組患者接受KN046 (5mg/kg Q3W)聯合化療(500mg/m2 Q3W的培美曲塞及AUC=5 Q3W的卡鉑), 直至出現疾病進展、毒性不耐受及其 它停藥指標。 主要研究終點:根據RECIST v1.1評估的ORR。 研究結果:截至2021年12月17日,有26名患者入組。截至數據截止日期(即2022年1月25日),中位隨訪時間爲11.56個月(95% CI:7.66至12.52)。 療效:在26名患者中,ORR爲26.9%(7/26,95% CI:11.57至47.79),DCR 爲80.8%(21/26,95% CI:60.65至93.45),其中7例達到PR,14例達到SD,CBR爲65.4%(17/26,95% CI:44.33至82.79)。中位PFS爲5.52個月(95% CI:4.17至6.77),中位OS爲12.68個月(95% CI:11.4至NR)。
安全性:該臨牀試驗的所有26名入組患者中,14名患者(53.8%)經歷過3級或 以上TRAE。最常見(≥10%)的TRAE包括貧血(42.3%,11名患者)、AST升高(42.3%,11名患者)及ALT升高(34.6%,9名患者)。 結論:KN046在治療既往EGFR-TKIs治療失敗的EGFR敏感性突變晚期NSCLC患者中展示出良好的耐受性和療效。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:康寧傑瑞公布PD-L1/CTLA-4雙抗KN046及KN026的4項最新數據
地址:https://www.breakthing.com/post/15940.html







