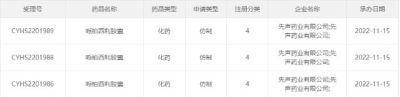
11月15日,CDE受理了先聲藥業遞交的4類化藥哌柏西利膠囊的仿制藥上市申請。目前,該品種已有十余家藥企仿制藥申報上市,並有齊魯制藥、豪森藥業、江西山香藥業等已獲批。據悉,該品種的原研專利在國內將於一個多月後到期,現已遭瘋搶,有多家藥企陸續遞交仿制藥上市申請,可以預見,此後市場競爭將愈發激烈。
哌柏西利(Palbociclib)原研來自輝瑞(商品名:Ibrance),2015年2月,輝瑞Ibrance通過加快審評在美國獲FDA 批准上市,成爲全球上市的首個CDK4/6抑制劑。上市後其全球銷售額每年均呈穩定增長,爲輝瑞帶來相當豐厚的收益,2020年Ibrance全球銷售額突破50億美元大關,2021年穩定增長至54億美元。
與哌柏西利在全球的炙手可熱不同,在國內的市場還較爲低淺,有待开拓。
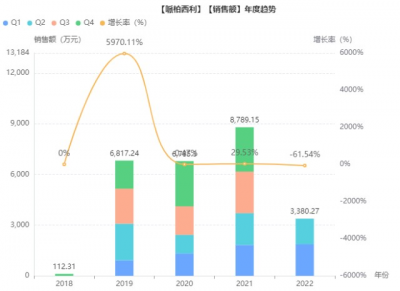
2018年7月,原研哌柏西利獲NMAP批准在國內上市,用於聯用芳香化酶抑制劑作爲初始內分泌療法治療HR+/HER2- 局部晚期或轉移性乳腺癌。據藥融雲統計,哌柏西利膠囊近年來在我國院內的銷售額雖平穩,但總體金額不大,市場有待开拓。2021年銷售額近9千萬元,期待今年能突破億元大關。
截圖來源:藥融雲全國醫院銷售數據庫
值得一提的是,2019-2021年,輝瑞的哌柏西利均“提名”醫保目錄,但最終均未順利進入醫保。
專利到期在即,齊魯制藥、豪森藥業、山香藥業蓄勢待發
據悉,原研哌柏西利在中國的化合物專利將於2023年1月10日到期,已不足2月,相關藥企早已布局,陸續還有藥企遞交仿制藥上市申請。
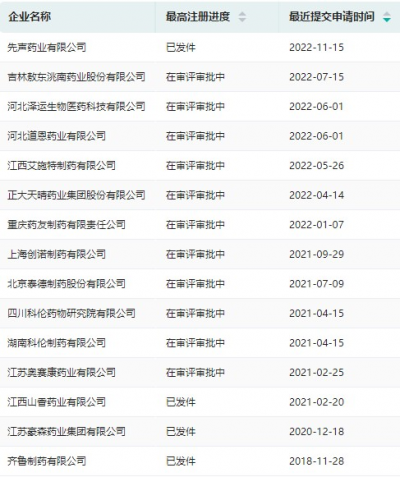
目前,齊魯制藥已於2020年12月拿下國內首仿,後江蘇豪森藥業、江西山香藥業等2家企業陸續獲得生產批文,原研專利到期後,國產哌柏西利將爲臨牀提供更多選擇。另有科倫藥業、藥友制藥以及此次的先聲藥業等十余家已遞交仿制藥上市申請,均已獲CDE受理,現在審評審批中。
哌柏西利膠囊的新注冊分類仿制藥申報概況(搜索"藥融雲小程序"進行相關更多數據查詢)
此外,齊魯制藥今年4月遞交了哌柏西利片的3類仿制藥上市申請,尚在審評審批中;8月,原研輝瑞的哌柏西利片獲NMPA批准在國內上市。另有石藥歐意已完成哌柏西利片的BE試驗。
參考來源:
[1]CDE官網
[2] 藥融雲數據庫
—END—
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:$54億乳腺癌藥物!先聲藥業遞交仿制藥上市申請,國內專利將到期
地址:https://www.breakthing.com/post/31160.html







