信達生物PI3K抑制劑申報上市
1年前

信達生物PI3K抑制劑申報上市
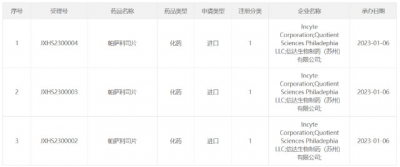
1月6日,CDE官網顯示,Incyte/信達生物帕薩利司片(Parsaclisib)申報上市,此前已被納入優先審評,擬用於既往接受過至少兩種系統性治療的復發或難治性濾泡性淋巴瘤成人患者。
 濾泡性淋巴瘤(FL)屬於非霍奇金淋巴瘤中的常見類型,其標准的一线療法爲R-CHOP(利妥昔單抗、環磷酰胺、多柔比星、長春新鹼和強的松)及類似方案。約20%的患者會出現早期進展;即使對於治療有效的大多數初治患者,仍經常復發並可能導致其在1-2 年內死亡。因此,復發或難治性FL領域仍存在尚未滿足的臨牀需求。 Parsaclisib是一種高活性、高選擇性的新一代口服PI3K抑制劑。PI3K是一個關鍵的B細胞受體信號中介,與惡性B細胞的生長、存活和增殖有關。臨牀前研究已證明其有效性與高選擇性,並且有潛力爲惡性血液腫瘤患者提供臨牀獲益。
濾泡性淋巴瘤(FL)屬於非霍奇金淋巴瘤中的常見類型,其標准的一线療法爲R-CHOP(利妥昔單抗、環磷酰胺、多柔比星、長春新鹼和強的松)及類似方案。約20%的患者會出現早期進展;即使對於治療有效的大多數初治患者,仍經常復發並可能導致其在1-2 年內死亡。因此,復發或難治性FL領域仍存在尚未滿足的臨牀需求。 Parsaclisib是一種高活性、高選擇性的新一代口服PI3K抑制劑。PI3K是一個關鍵的B細胞受體信號中介,與惡性B細胞的生長、存活和增殖有關。臨牀前研究已證明其有效性與高選擇性,並且有潛力爲惡性血液腫瘤患者提供臨牀獲益。 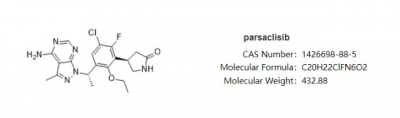
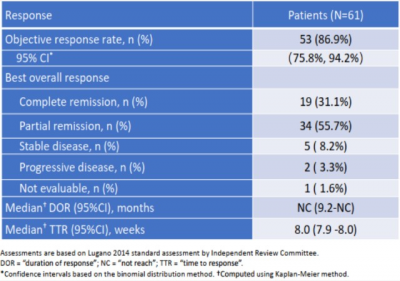
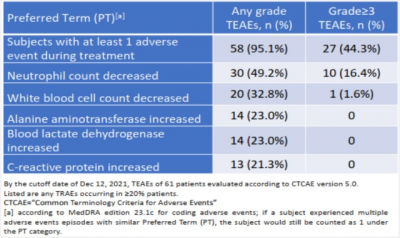
2018年12月,信達生物與Incyte就Parsaclisib、Pemigatinib(FGFR1/2/3抑制劑)和Itacitinib(JAK1抑制劑)達成战略合作,獲得了這3款藥物在中國大陸及港澳台的开發和商業化權利。 2021年3月,Parsaclisib針對同一適應症獲NMPA的突破性療法認定。 2022年6月,信達生物在ASCO大會上更新了Parsaclisib的中國關鍵II期研究結果。截至2021年12月,在61例復發或難治性FL患者中,客觀緩解率(ORR)達86.9%(95%CI : 75.8%-94.2%),其中31.1%的患者實現完全緩解。中位無進展生存期(mPFS)和中位總生存期(mOS)尚未達到。
 值得注意的是,Incyte於2022年1月宣布,因無法在支持投資的時間段內完成FDA要求的確證性試驗,故已撤回Parsaclisib治療FL、邊緣區淋巴瘤和套細胞淋巴瘤的上市申請,並表示這是一項商業決定與Parsaclisib的療效或安全性無關。 目前,國內已有2款PI3K抑制劑獲批上市,適應症與此次Parsaclisib申請的相同,皆用於復發或難治性FL的三线治療。2022年3月,度維利塞率先獲得NMPA批准,石藥集團擁有該產品在中國的獨家權益。同年11月,瓔黎藥業自主研發的林普利塞獲批上市,恆瑞醫藥擁有林普利塞在大中華地區的聯合开發權益以及排他性獨家商業化權益。 Copyright 2023 PHARMCUBE. All Rights Reserved.
值得注意的是,Incyte於2022年1月宣布,因無法在支持投資的時間段內完成FDA要求的確證性試驗,故已撤回Parsaclisib治療FL、邊緣區淋巴瘤和套細胞淋巴瘤的上市申請,並表示這是一項商業決定與Parsaclisib的療效或安全性無關。 目前,國內已有2款PI3K抑制劑獲批上市,適應症與此次Parsaclisib申請的相同,皆用於復發或難治性FL的三线治療。2022年3月,度維利塞率先獲得NMPA批准,石藥集團擁有該產品在中國的獨家權益。同年11月,瓔黎藥業自主研發的林普利塞獲批上市,恆瑞醫藥擁有林普利塞在大中華地區的聯合开發權益以及排他性獨家商業化權益。 Copyright 2023 PHARMCUBE. All Rights Reserved. 免責申明:本微信文章中的信息僅供一般參考之用,不可直接作爲決策內容,醫藥魔方不對任何主體因使用本文內容而導致的任何損失承擔責任。
追加內容
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:信達生物PI3K抑制劑申報上市
地址:https://www.breakthing.com/post/39020.html







