
1月11日,CDE網站顯示,禮來的度拉糖肽(Trulicity)新適應症上市申請獲藥監局受理,根據禮來此前公布的中國III期臨牀完成情況,推測本次申報上市的新適應症爲度拉糖肽聯合胰島素治療成人2型糖尿病。  度拉糖肽是一款長效GLP-1受體激動劑,也是當前最暢銷的GLP-1類藥物之一,禮來2022年Q3財報顯示,前三季度度拉糖肽實現了約55億美元的銷售額,同比增長20%。2022年7月,禮來公布了一項在中國進行的多中心、隨機、雙盲、平行組、安慰劑對照III期AWARD-CHN3研究的積極數據,該研究共納入291例成人2型糖尿病患者,由全國27家研究中心參與完成。入組受試者平均糖尿病病程爲11.8年,基线HbA1c爲8.59%,基线體重爲71.85 kg,基线基礎胰島素劑量爲每日18.54 IU。在接受甘精胰島素(伴二甲雙胍治療和/或阿卡波糖)治療血糖仍控制不佳的中國成人2型糖尿病患者中,聯合使用度拉糖肽1.5mg在28周HbA1c較基线的變化方面優效於聯合使用安慰劑。 該研究主要終點是評估28周時HbA1c較基线的變化在滴定的甘精胰島素聯合使用度拉糖肽1.5mg相比於聯合使用安慰劑的優效性;次要終點評估了血糖控制的其他指標和體重變化,包括:達到HbA1c
度拉糖肽是一款長效GLP-1受體激動劑,也是當前最暢銷的GLP-1類藥物之一,禮來2022年Q3財報顯示,前三季度度拉糖肽實現了約55億美元的銷售額,同比增長20%。2022年7月,禮來公布了一項在中國進行的多中心、隨機、雙盲、平行組、安慰劑對照III期AWARD-CHN3研究的積極數據,該研究共納入291例成人2型糖尿病患者,由全國27家研究中心參與完成。入組受試者平均糖尿病病程爲11.8年,基线HbA1c爲8.59%,基线體重爲71.85 kg,基线基礎胰島素劑量爲每日18.54 IU。在接受甘精胰島素(伴二甲雙胍治療和/或阿卡波糖)治療血糖仍控制不佳的中國成人2型糖尿病患者中,聯合使用度拉糖肽1.5mg在28周HbA1c較基线的變化方面優效於聯合使用安慰劑。 該研究主要終點是評估28周時HbA1c較基线的變化在滴定的甘精胰島素聯合使用度拉糖肽1.5mg相比於聯合使用安慰劑的優效性;次要終點評估了血糖控制的其他指標和體重變化,包括:達到HbA1c
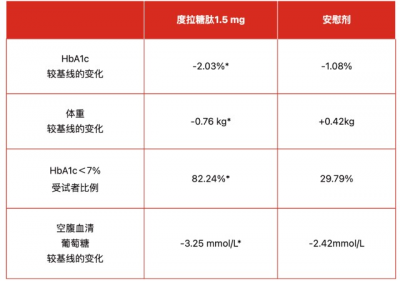
安全性方面,AWARD-CHN3研究中,度拉糖肽1.5 mg的安全性特徵與既往AWARD系列研究一致。與藥物相關最常見的不良反應是食欲減退、腹瀉、惡心等,通常爲輕、中度,且隨着持續給藥而不斷減少。度拉糖肽1.5 mg組的總體低血糖發生率在數值方面與安慰劑無差異,未報告任何臨牀顯著性低血糖(
度拉糖肽於2014年9月首次獲得美國FDA批准上市,2019年2月進入中國市場,用於成人2型糖尿病患者的血糖控制。除此之外,用於降低伴有心血管疾病或具有多重心血管風險因子的成人2型糖尿病患者的主要心血管事件風險的新適應症於2020年2月首獲FDA批准上市,成爲首款可以用於2型糖尿病患者一級預防和二級預防以降低主要心血管事件風險的降糖藥。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:禮來「度拉糖肽」新適應症在華申報上市
地址:https://www.breakthing.com/post/40149.html







