阿斯利康長效補體C5抑制劑國內申報臨牀
1年前

阿斯利康長效補體C5抑制劑國內申報臨牀
2月9日,阿斯利康收購的補體賽道龍頭企業Alexion補體C5抑制劑ravulizumab臨牀申請獲CDE受理,這是該藥物在國內申報的第2項臨牀試驗申請。 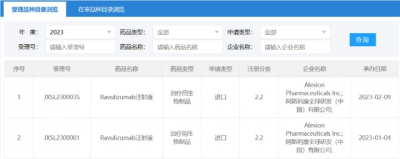 Ravulizumab是一款長效補體C5抑制劑,最早於2018年12月獲FDA批准上市,用於治療陣發性睡眠性血紅蛋白尿症(PNH),商品名爲Ultomiris;2021年9月,ravulizumab新適應症獲FDA批准,用於治療非典型溶血性尿毒症綜合徵(aHUS)的成人及兒童(一個月以上)患者;2022年4月,ravulizumab第3項適應症獲FDA批准,用於治療成人全身型重症肌無力(gMG)。 Alexion是補體生物學研究的先驅,开發了全球首個補體C5抑制劑Soliris(依庫珠單抗)和首個長效C5補體抑制劑Ultomiris。2020年12月12日,阿斯利康以390億美元收購Alexion獲得了這兩款最重要的上市產品。Soliris已於2018年9月4日獲NMPA批准上市,先後獲批用於治療兒童及成人PNH和aHUS。Ultomiris只需每8周靜脈注射1次,與每2周注射1次的Soliris相比,可將患者每年的用藥次數從26次減少到6次。 根據阿斯利康財報,2022年,Soliris和Ultomiris全球銷售額分別爲37.62億美元和19.65億美元。
Ravulizumab是一款長效補體C5抑制劑,最早於2018年12月獲FDA批准上市,用於治療陣發性睡眠性血紅蛋白尿症(PNH),商品名爲Ultomiris;2021年9月,ravulizumab新適應症獲FDA批准,用於治療非典型溶血性尿毒症綜合徵(aHUS)的成人及兒童(一個月以上)患者;2022年4月,ravulizumab第3項適應症獲FDA批准,用於治療成人全身型重症肌無力(gMG)。 Alexion是補體生物學研究的先驅,开發了全球首個補體C5抑制劑Soliris(依庫珠單抗)和首個長效C5補體抑制劑Ultomiris。2020年12月12日,阿斯利康以390億美元收購Alexion獲得了這兩款最重要的上市產品。Soliris已於2018年9月4日獲NMPA批准上市,先後獲批用於治療兒童及成人PNH和aHUS。Ultomiris只需每8周靜脈注射1次,與每2周注射1次的Soliris相比,可將患者每年的用藥次數從26次減少到6次。 根據阿斯利康財報,2022年,Soliris和Ultomiris全球銷售額分別爲37.62億美元和19.65億美元。
 Ravulizumab是一款長效補體C5抑制劑,最早於2018年12月獲FDA批准上市,用於治療陣發性睡眠性血紅蛋白尿症(PNH),商品名爲Ultomiris;2021年9月,ravulizumab新適應症獲FDA批准,用於治療非典型溶血性尿毒症綜合徵(aHUS)的成人及兒童(一個月以上)患者;2022年4月,ravulizumab第3項適應症獲FDA批准,用於治療成人全身型重症肌無力(gMG)。 Alexion是補體生物學研究的先驅,开發了全球首個補體C5抑制劑Soliris(依庫珠單抗)和首個長效C5補體抑制劑Ultomiris。2020年12月12日,阿斯利康以390億美元收購Alexion獲得了這兩款最重要的上市產品。Soliris已於2018年9月4日獲NMPA批准上市,先後獲批用於治療兒童及成人PNH和aHUS。Ultomiris只需每8周靜脈注射1次,與每2周注射1次的Soliris相比,可將患者每年的用藥次數從26次減少到6次。 根據阿斯利康財報,2022年,Soliris和Ultomiris全球銷售額分別爲37.62億美元和19.65億美元。
Ravulizumab是一款長效補體C5抑制劑,最早於2018年12月獲FDA批准上市,用於治療陣發性睡眠性血紅蛋白尿症(PNH),商品名爲Ultomiris;2021年9月,ravulizumab新適應症獲FDA批准,用於治療非典型溶血性尿毒症綜合徵(aHUS)的成人及兒童(一個月以上)患者;2022年4月,ravulizumab第3項適應症獲FDA批准,用於治療成人全身型重症肌無力(gMG)。 Alexion是補體生物學研究的先驅,开發了全球首個補體C5抑制劑Soliris(依庫珠單抗)和首個長效C5補體抑制劑Ultomiris。2020年12月12日,阿斯利康以390億美元收購Alexion獲得了這兩款最重要的上市產品。Soliris已於2018年9月4日獲NMPA批准上市,先後獲批用於治療兒童及成人PNH和aHUS。Ultomiris只需每8周靜脈注射1次,與每2周注射1次的Soliris相比,可將患者每年的用藥次數從26次減少到6次。 根據阿斯利康財報,2022年,Soliris和Ultomiris全球銷售額分別爲37.62億美元和19.65億美元。
追加內容
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:阿斯利康長效補體C5抑制劑國內申報臨牀
地址:https://www.breakthing.com/post/46390.html







