
3月27日,$石藥集團(HK|01093)$發布公告,其阿普米司特片(10mg,20mg,30mg)獲得藥品注冊批件,用於治療符合接受光療或系統治療指徵的中度至重度斑塊狀銀屑病的成人患者。此前曾有多家企業以仿制新3類報產該$22億銀屑病高難度品種,但均折戟成沙,終未獲批。石藥集團爲這一熱門品種的“國內首仿藥+首家過評”。

阿普斯特/阿普米司特(apremilast)原研由新基(Celgene)研發,是過去二十多年用於銀屑病/銀屑病關節炎治療的首個口服新藥。在全球市場,阿普米司特片於2021年3月首次面世,被美國FDA批准用於治療成人活動性銀屑病性關節炎、符合接受光療或系統治療指徵的中度至重度斑塊狀銀屑病的成人患者。截止目前,阿普米司特已在美國、歐盟、加拿大、挪威、日本、中國等50多個國家獲批,進入市場銷售。
阿普米司特研發現狀(搜索"藥融雲小程序"進行相關更多數據查詢)
2019年8月,安進以高達134億美元的價格獲得了阿普米司特的全球權益。2021年8月,安進在中國提交的阿普米司特上市申請獲批,用於治療符合接受光療或系統治療指徵的中度至重度斑塊狀銀屑病的成人患者。這是中國首個獲批用於斑塊狀銀屑病治療的口服PDE4抑制劑。據藥融雲全球藥物研發數據庫顯示,阿普米司特在2020年度實現21.95億美元的全球銷售額;2021財年爲22.49億美元。
我國約有650萬銀屑病患者,中重度患者約佔57.3%。故國內對於銀屑病相關治療藥物的需求十分迫切。
2022年6月,$復星醫藥(SH600196)$與安進宣布,就兩款創新藥物——歐泰樂(阿普米司特片)和Parv在中國境內(不包括港澳台地區)的商業化授權許可先後達成合作。2022年底,復星醫藥的阿普米司特片通過談判進入醫保目錄(乙類)。不言而喻,該產品在我國的銷售前景備受看好。因此,國內有多家企業進行積極布局,對於國內首仿藥的位置更是虎視眈眈。
阿普米司特原研批文

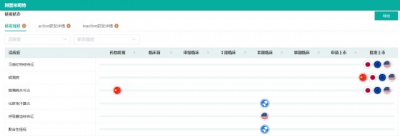
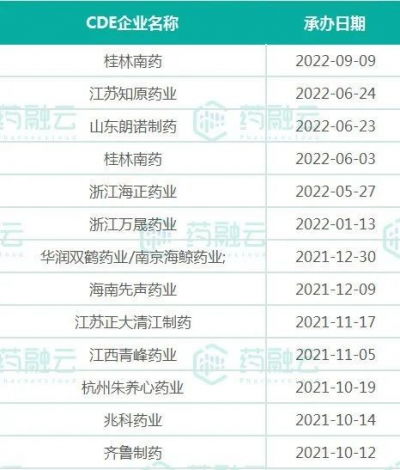
2021年8月(原研未在中國獲批上市)以前,國內已有多家藥企按化藥3類遞交了上市申請,但由於本品爲高難度品種,故均未被批准上市。目前,國內也已有十余家藥企先後遞交4類仿制上市申請,其中不乏齊魯制藥、先聲藥業、兆科藥業、$華潤雙鶴(SH600062)$、青峰藥業等明星藥企。此次石藥集團歐意藥業獲批,順利拿下阿普米司特片的國內首仿藥,同時也是國內首家過評的藥企。
阿普米司特片報產在審企業
參考來源:
[1] 藥融雲數據庫
[2] CDE官網/NMPA官網
[3] 石藥集團公司官方披露
END
糾正:在全球市場,阿普米司特片於2014年3月首次面世。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:$22億銀屑病高難度品種!石藥集團過評,拿下國內首仿藥!
地址:https://www.breakthing.com/post/50647.html







