近日,TOP期刊JACS更新了一篇Article,文章回顧了羅氏公司的子公司日本Chugai從篩出的hit優化到KRAS臨牀抑制劑Luna-18的研發過程。Luna-18是一種靶向細胞內蛋白的環肽,在未使用特殊配方的情況下,口服生物利用度依然達到(21-47%),目前處於臨牀一期,招募了195名患者,預計2025年3月31日結束一期。適應症爲局部晚期或轉移性實體瘤。
如圖1,爲羅氏公司今年四月份更新的部分腫瘤臨牀管线,箭頭標記的即爲LUNA18項目,臨牀注冊爲RAS抑制劑,於2021年8月進行實體腫瘤(聯合治療、單藥治療、轉移性疾病、晚期疾病、復發性疾病)(PO,膠囊)的I期臨牀試驗(NCT05012618)。黃色部分均爲在全球开展的臨牀項目,藍色字體爲羅氏授權在日本开發或銷售的項目,其中就有一直比較火熱的KRAS G12C和SHP2管线。

圖1 羅氏公司腫瘤管线(2023年4月27日更新)
其實在2022年8月份,Chugai公司便在JMC雜志報道過一類廣泛適用的合成方法來合成富含N -烷基的類藥物環肽,N-烷基化的目的在於減少氫鍵供體、改善吸收以滿足口服藥物的需求。如圖2A所示,這是一種通用的平行合成方法來獲得高度和隨機N-烷基化的類藥物環肽,該方法滿足了克服三個挑战性問題的復雜要求:DKP(環縮二氨酸)的形成、由於位阻導致酰胺化反應性不足和酸性條件下環肽的不穩定性。JMC報道了兩種不同酸強度的反應條件,以保持酸不穩定的類藥環肽的穩定性;利用該方法合成出來4000多條環肽,最終發現了臨牀環狀肽LUNA18,當時這篇JMC並未提到根據哪個hit進行優化,重點在於報道合成方法的突破。整條路线下來,能達到31%的收率和終產物97%的純度。
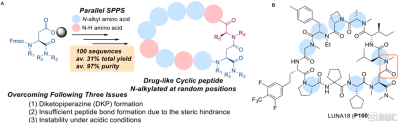
圖2 類藥性環肽合成方法突破並合成出LUNA 18
如圖3所示,Chugai公司經過篩選,從mRNA展示文庫中的AP8747未經骨架躍遷,經過化學優化,圍繞着增加多肽的血漿穩定性、改善吸收、降低清除、減少氫鍵給體;最終發現了具有口服生物利用度的臨牀化合物LUNA18(減少了兩個氫鍵供體),這是一種針對細胞內的靶點RAS的11-mer環肽抑制劑。
亮點發現主要在以下幾點:(i)鑑定出兩個肽側鏈,每個側鏈將RAS親和力提高10倍以上;(ii)包括Clog P在內的理化性質可通過側鏈修飾來調節,以增加膜的通透性;(iii)限制環肽構象可有效調節多肽的理化性質,提高生物活性;(iv)在Caco-2滲透性試驗中,觀察到滲透性提升到0.4×10−6 cm/s及以上並使得細胞活性從AP8784的20000nM以上提升到LUNA18的1.4nM,提高14000倍以上;(v)微觀上確認了,在保持環肽主鏈構象不變時,RAS蛋白的結構可通過誘導與肽側鏈的匹配而發生巨大的變化。
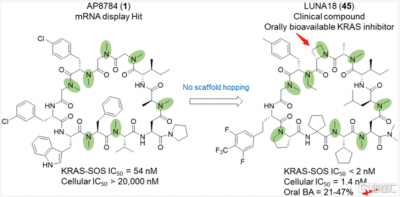
圖3 從AP8784到LUNA18(未發生骨架躍遷)
然而,比較可惜的是文章中並未給出LUNA18的動物PK數據,在後續的文章中將披露更多的數據(A platform to create oral drugs beyond rule of 5 for intracellular tough targets. J. Am. Chem. Soc., Submitted)。這篇JACS只給出了化合物40的小鼠PK數據,如圖4所示,5mpk iv給藥下暴露量有65200ng h/ml,半衰期達到3個小時以上,Vss只有0.2L/kg;但是放大10倍劑量口服後,小鼠的暴露量卻還達不到iv的效果,生物利用度只有7.6%,這顯然未達到口服藥物的要求。雖然索馬魯肽的口服生物利用度只有0.8%,這會給制劑帶來巨大的挑战。化合物40仍然需要對吸收和清除進一步優化。

圖4 化合物40的結構和小鼠PK數據
如圖5所示,化合物40和LUNA18只在四個氨基酸上有差別。參考SAR具有以下三個特徵:(i)位置5的側鏈更傾向於芳香而不是脂肪族;(ii)在11號位置可以調整PCP;(iii)調整位置7和10的氨基酸可增強生物活性。在這個策略的指導下,把化合物40的5位置的環己烷基改爲對甲苄基;7位置上的氯三氟甲基苯環改爲二氟三氟甲基苯環;位置10的異丙基改爲了環戊基;11位置則把甲基改爲了N,N-二甲酰胺基。化合物45的細胞IC50爲1.4 nM (AsPC-1),Caco-2 Papp爲2.3×10−6 cm/s。相比化合物40,各方面數據有了整體提升。
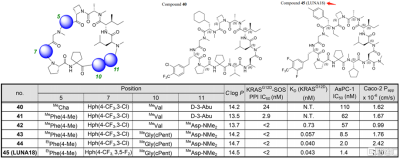
圖5 化合物40和LUNA18的結構和體外數據對比
除了AsPC-1外,化合物45對KRAS基因改變的細胞系,都顯示出顯著的細胞活性(IC50=0.17-2.9nM)。如LS180(結腸癌,KRASG12D)、GSU(胃癌,KRASG12D)、NCI-H441(非小細胞肺癌,KRASG12V)、NCI-H2122 (非小細胞肺癌, KRASG12C)和MiaPaCa-2(胰腺癌,KRASG12C)。
在NCI-H441或MiaPaCa-2異種移植物小鼠中評估了luna-18的體內療效。化合物luna18每天口服1次,連用14 d,測定小鼠體重和腫瘤體積。在劑量爲10 mg/kg時,觀察到腫瘤消退,且沒有明顯的體重減輕。
在小鼠、大鼠、猴子和犬體內進行了luna18的PK研究。經口服給藥後,化合物luna18在這4種動物體內的生物利用度爲21-47%。這些結果表明,luna18這種環肽作爲一種口服藥物具有治療潛力,可以治療含有KRAS基因突變的多種癌症。目前,45 (LUNA18)正在日本/美國進行一期臨牀試驗。
值得關注的是,本篇文章中的環肽分子對KRAS G12D突變的細胞具有非常強效的抑制活性,體內藥效的情況目前沒有數據披露,如果體內藥效也能保持強效,這必然會加強KRAS G12D口服抑制劑的內卷。吸引國內外衆多公司follow這類環肽抑制劑。
圖6 MRTX1133處於臨牀I/Ib期
KRAS G12D突變影響了美國和歐洲約18萬名患者,與KRAS G12C突變相比,患病率增加了約2.5倍。目前尚無針對這些患者的靶向腫瘤治療方案。在臨牀前KRASG12D突變的胰腺癌模型以及肺癌和結直腸癌模型中,MRTX1133給予顯著的腫瘤應答。MRTX1133具有良好的藥物特性,包括脫靶活性和藥物相互作用的低風險,預計人體半衰期大於50小時。
目前,全球僅MRTX1133一款口服G12D抑制劑於2023年1月獲得FDA批准,正在臨牀I/Ib進行研究,恆瑞此前申報的KRAS G12D抑制劑也是一款注射藥物,其他口服G12D抑制劑均處於臨牀前研究階段。MRTX1133已發現兩年之久,文章也報道多時,但由於口服生物利用度極低,一直未能申報IND,最後通過制劑手段實現了口服給藥,但AUC也僅僅提高了10倍左右,生物利用度仍然很低,存在很大的優化空間。
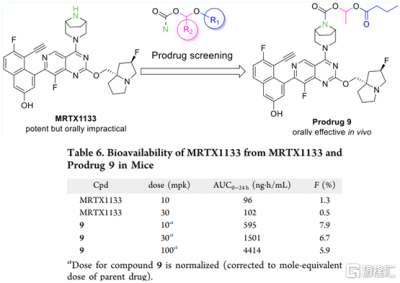
圖7 前藥實現MRTX1133的口服生物利用度的提升
此外,如圖7,上海潤佳醫藥報道了前藥策略改善MRTX1133的口服生物利用度,把MRTX1133做成氨基甲酸酯衍生物的形式。前藥9與母體化合物相比在小鼠體內表現出改善的藥代動力學特性(F由0.5-1.3%提升到6.7-7.9%),並且口服KRASG12D突變異種移植小鼠腫瘤模型有效。
前藥策略雖能改善化合物的理化性質、PK性質,以及增加藥物研發的可靠性和有效性等,但由於前藥的研究涉及到不同於“正常”藥物諸如合成、藥效、藥代及毒理等方面的研發過程,這些都是未知的風險,故而必須慎重選擇。
總之,KRAS G12D抑制劑的开發存在很高的技術壁壘,不僅要突破G12D難成藥的障礙,還要解決口服PK差的難題。面對這迫切的未滿足的臨牀需求,對各大制藥公司來說,口服KRAS G12D抑制劑的开發既是重大挑战也是難得的機遇。
本文作者可以追加內容哦 !
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播信息之目的,不構成任何投資建議,如有侵權行為,請第一時間聯絡我們修改或刪除,多謝。
標題:羅氏報道臨牀試驗I期口服環肽KRASG12D抑制劑
地址:https://www.breakthing.com/post/81427.html







